
생체역학(biomechanics)과 생물학은 항상 인류를 매혹시켜왔고, 이런 이유때문에라도 근골격계에 대한 생체역학의 중요성이 과소평가되어서는 안된다. 최근 몇년동안 세계의 연구추세는 유전학과 분자생물학쪽으로 집중되고 있지만 신체전반과 구조에 대한 역학적 연구는 여전히 중요하다. 근골격계 질환은 전세계적으로 가장 흔한 질환이며, 이 질환은 사람의 연령이 증가함에 따라 발생할 확률이 계속 높아지고 있다.
생체역학은 생체공학과 생체 의공학의 한 분야다. 생체역학은 정역학과 동역학으로 나뉜다. 정역학의 원리는 근골격 시스템 가운데 여러관절과 근육속에 관계하고 있는 힘의 성질과 크기를 분석하기 위해 적용되어져 왔다. 동역학의 원리는 운동기술 분석, 보행분석, 분절운동 분석 그리고 운동역학 분야에서 많이 적용된다.
생체역학에 관한 실험적 연구는 뼈, 연골, 근육, 건, 인대, 피부와 혈액을 포함하는 전체 또는 그들을 구성하고 있는 일부의 생물학적 요소에 대해 역학적 특성을 규명하기 위해 이루어진다.
제 1장. 생체역학의 개요. 용어와 개념
스칼라(scalar) - 스칼라는 오직 크기만을 가진 물리량(질량, 에너지, 힘, 온도, 기계적인 일)
벡터(vector) - 크기와 방향을 포함하는 물리양(모멘트, 속도, 가속도)
텐서(tensor) - 스칼라는 0 tensor, 벡터는 first-order tensor, 변형력(stress) 변형(strains)은 second-order tensor
토크(torque) - 토크는 회전운동과 비트는 동작에 작용하는 힘
모멘트(moment) - 구부리는 동작과 연관된 힘. 무멘트와 토크의 수학적 정의는 동일한 것다. 토크와 모멘트 역시 벡터량이다.
free-body diagrams 다음에 정확히 이해해야
정역학의 목적에 대한 질문
# 어떤 자세에서 머리를 지지하기 위하여 관련된 목의 어떤 신전근이 작용해야만 하는가?
# 어떤 사람이 구부리고 있을때 제5번 요추골위에서 척추기립근에 의해서 발휘되는 힘은 무엇인가?
stress-strain diagram

탄성과 가소성 변형(elastic and plastic deformations)
- 탄성(elasticity)은 적용된 부하로 없어진 모양과 크기가 다시 원래의 모습을 찾는 능력
- 가소성(plasticity)은 물질이 그들의 탄성한계를 넘어서 부하를 줄때, 탄성적 변형을 따라 가소성 변형이 진행
점탄성(viscoelasticity)
- 점성(viscosity)는 액체물질의 특성으로 흐름에 대한 저항값이다. 탄성은 고체물질의 특성. 점탄성은 액체과 고체의 특성을 모두 개념이다. 점탄성의 성질을 가진 인체관절은 스트레스-이완실험에서 고체의 성질을 가진 탄성의 스트레스-이완실험과는 다른 결과를 나타낸다.

제 2장. 뼈의 생체역학
- 골격계는 내장기관을 보호하고, 단단한 운동링크(rigid kinematic links)와 근 부착점을 제공하며, 근활동과 인체 운동을 촉진하는 역할. 뼈는 인체에서 가장 견고한 구조물로 독특한 구조적, 역학적 특성을 가지고 자신의 역할을 수행
뼈의 성분과 구조
- 뼈조직은 지지와 보호역할에 적합한 고체성분의 특수한 결합조직(special connective tissue)
- 뼈는 다른 결합조직과 마찬가지로 섬유의 유기질인 세포외기질(extracellular matrix) 기질(ground substance), 세포로 구성
- 다른 결합조직과의 차이는 mineral salt 형태로 된 무기질을 많이가지고 있다는 것
- 뼈의 무기질(주로 칼슘과 인)은 뼈를 견고하게 하는 역할, 유기성분은 유연성과 탄성을 제공
- 건조중량의 60-70%에 해당하는 무기질은 뼈의 견고도를 제공, 뼈조직은 5-8%의 수분을 함유하고 있고 나머지는 유기질로 구성
- 뼈의 무기질은 여러방향으로 엉켜있는 세포외기질의 섬유인 collagen섬유속에 묻혀있다. collagen type1은 거칠고 유연하지만 신장력에 매우 약한 편이다. 세포외기질의 약 90%가 collagen으로 되어 있고, 뼈 건조중량의 25-50%가 교원질로 구성되어있다.
- 교원섬유를 둘러싸고 있는 젤성의 기질은 주로 다당류 단백이나 글라이코스아미노글리칸(GAGs)로 구성되어 있다 GAGs은 주로 프로테오글리칸이라는 거대분자 복합체의 형태로 되어있다. GAGs는 무기질의 고원섬유층 사이에서 고착화기질로 작용한다.
뼈에 가해지는 다양한 부하
- tension, compression, bending, shear, torsion, combined loading
다음에 다시 정리해야
제 3장. 관절연골의 생체역학
인체는 섬유성, 연골성, 활막성의 세가지 형태의 관절. 이중 활막성 관절만이 많은 움직임을 허용. 정상관절에서 가동관절의 골단은 초자연골(hyaline articular cartilage)이라는 얇고(1~6mm), 치밀하고, 방사선 투과성의 흰색 결합조직으로 덮여있다. 생화학적으로는 혈관, 림프관, 신경지배가 없는 분리된 조직.
가동관절의 관절 연골의 두가지 기능
첫째, 관절의 부하를 넓은 부위로 분산시켜 접촉하는 관절면의 스트레스 감소
둘째, 마주하고 있는 관절면이 마찰과 마모를 최소로 하면서 서로 움직이도록 하는 역할
읽을 논문

Regeneration and repair of tendon and ligament tissue using.pdf
관절연골의 구조와 조성
- 연골세포(chondrocyte)는 관절연골에서 성기게 분포한 세포로서 조직용적의 10%이하를 차지. 연골세포는 성긴 분포에도 불구하고 세포외 물질의 기질성분을 만들고 분비하며, 기질화를 유지. 기질성분은 프로테오글리칸 용액속에서 그물을 이루고 있는 미세한 교원섬유(대부분 2형 교원질이며, 다른형도 존재)의 조밀한 망으로 구성.
- 교원섬유와 PGs(프로테오글리칸)은 각각 상당한 강도의 구조적 망을 형성하는 것이 가능하여, 관절연골에 가해지는 부하로 인해 내부의 역학적 스트레스를 지지하는 구조적 구성성분

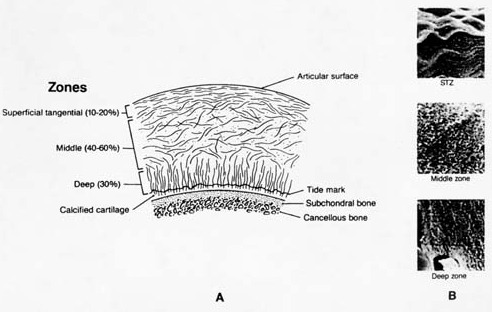
관절연골의 교원질은 3가지 층으로 구성(Mow 1974)
가) 표면접선층(superficial tangential zone)
- 전체 두깨의 10-20%, 관절표면과 평행하게 치밀하게 묶여진 섬유배열
나) 중간층(middle zone)
- 전체 두깨의 40-60%, 무작위 섬유배열
다) 심층(deep zone)
- 전체두깨의 30%, 섬유다발이 방사상배열, 이들 섬유다발은 관절연골과 그 아래 석회층 연골사이의 접점인 tidemark을 지나 뼈로 연결되어 연골과 뼈가 단단히 부착되도록 뿌리체계를 형성
- 이러한 비등방성의 섬유(anisotropic fiber) 배열은 관절조직의 부하를 받는 스트레스를 분산하는 중요한 생체역학적 기능제공
- 관절연골은 뼈와같이 물질적인 조성이 부하의 방향에 따라 달라지는 anisotropic이다. 비등방성은 관절연골의 평탄한 면에 다양한 교원질 섬유배열과 관계가 있다.
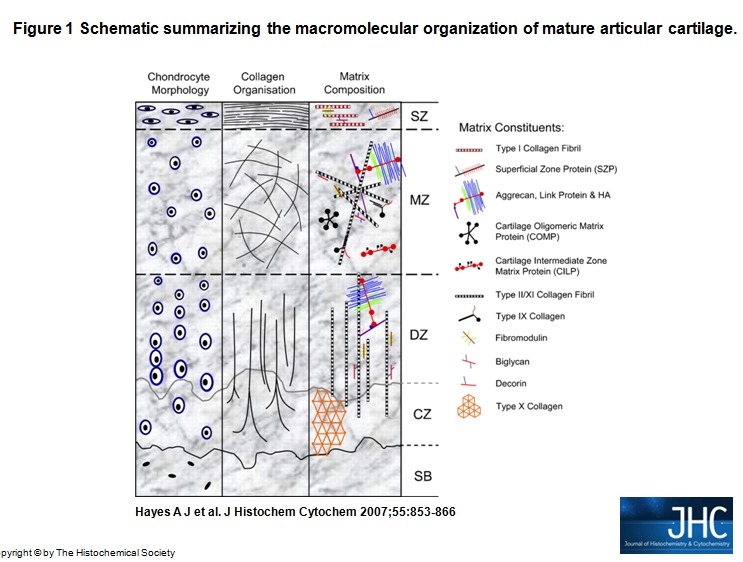
Schematic summarizing the macromolecular organization of mature articular cartilage. The tissue consists of four distinct zones: superficial (SZ); middle (MZ), deep (DZ), and a zone of calcified cartilage matrix (CZ), below which is the subchondral bone (SB). Each zone is distinct in terms of its cell morphology (left panel), collagen fiber organization (middle panel), and the biochemical composition of its extracellular matrix (ECM) (right panel). Matrix constituents of each cartilage zone are presented as molecular schematics.
1) 교원질(collagen)
- 관절연골에서 교원질(collagen)은 섬유성의 초미세구조인 고도의 구조적 구성물을 구성.
- 연골은 주로 2형 교원질로 이루어져 있다. 추가로 다른 교원질은 관절연골내에 적은 양이 배열되어 있다. 2형교원질은 주로 고나절연골, 비중격, 흉부연골뿐 아니라 추감판의 내측, 그리고 반월판에 존재.
- 1형 교원질은 인체에서 가장 풍족한 교원질이며, 뼈와 추간판(주로 수핵), 피부, 반월판, 건, 인대 등과 같은 연부조직에서 발견된다. 교원섬유의 가장 중요한 역학적 특성은 장력과 힘이다. 교원섬유는 장력(tension)에는 견고하고 강하지만 압박에는 쉽게 휘어지는 특성이 있다.
- 여러가지 신체조직에서 모교원질 알파사슬의 차이에 따라 특정 분자의 종류나 교원질의 형태를 나타낸다. 초자연골에 있는 2형 교원질은 뼈, 인대, 건에 있는 1형 교원질과는 다르다. 2형교원질은 1형 교원질보다는 섬유가 더 가늘기 때문에 교원질이 연골조직 전체에 최대로 흩어져 있을 수 있다.
참고) 교원질 형태차이
- 여러가지 신체조직에서 모교원질 알파사슬의 차이에 따라 특정분자의 종류나 교원질의 형태를 나타낸다. 초자연골에 있는 2형 교원질은 뼈, 인대, 그리고 건에 있는 1형 교원질과는 다르다. 2형 교원질은 1형 보다는 섬유가 더 가늘기 때문에 교원질이 연골조직 전체에 최대로 흩어져 있을 수 있다.
Collagen is a family of proteins; in animals these proteins play critical roles in tissue architecture, tissue strength, and cell to cell relationships. The major component of all connective tissue matrixes, collagen is found in tissues such as skin, blood vessels, bone, tendon, and ligament, and is characterized by tremendous strength.
The word "collagen" derives from the Greek word for "glue"; this derivation is based on the observation that insoluble collagen, when heated in water, becomes soluble, gummy gelatin that can be used in the manufacture of glues or as a thickener in foods. There are ten known forms of collagen that, because of differences in functional requirements and chemical environments, differ in some details of composition.
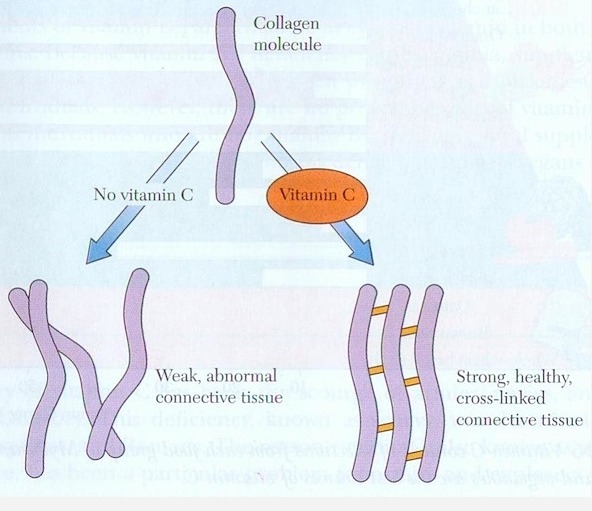
An individual collagen polypeptide chain has a large number of repeating amino acid sequences, most often glycine–X–Y, where X is often proline and Y is often hydroxyproline. Lysine, in its pure form or modified to hydroxylysine, is also found in collagen. Both hydroxyproline and hydroxylysine are formed via the enzyme-catalyzed oxidations of the proline and lysine amino acid side chains, which occur after the collagen polypeptide has been synthesized. These enzymatic reactions require ascorbic acid ( vitamin C) as a cofactor .
Individual collagen polypeptides form an extended, left-handed triple helix, which is longer and less compact than the α -helixes often seen in proteins. Three of these helixes then form a molecule of tropocollagen , the basic building block of collagen, by coiling around a central axis in a right-handed, triple-helical arrangement. The side chain of every third amino acid is very close to the central axis of this superhelix . Glycine, with the smallest side chain of any amino acid, is more easily accommodated in these arrangements than the larger, bulkier amino acids.
Tropocollagen molecules associate in a staggered fashion to form collagen fibrils , which are stronger than steel wire of similar size. Collagen fibrils are strengthened and stabilized mainly by covalent cross-links, existing both within and between individual tropocollagen molecules. These crosslinks represent the enzyme-catalyzed formation of covalent bonds involving lysine and hydroxylysine side chains. The extent of cross-linking depends on the specific function of the collagen molecule involved and the age of the animal; older animals have more highly cross-linked and therefore more rigid collagen.
There are a number of collagen-related disorders that have been identified. Many of these are the result of derangements in the biosynthesis of collagen. Scurvy, characterized by bleeding gums, loose teeth, skin lesions, and weakened blood vessels, results from severe vitamin C deficiency, which makes it almost impossible for afflicted individuals to form hydroxyproline and hydroxylysine. The conditions, known collectively as the Ehlers–Danlo syndromes, result from defects in the processing of collagen polypeptides.
In addition to its importance in the production of animal glue, collagen is the basis for gelatin, which forms when collagen fibers are denatured as a result of heating and then get tangled up with each other. Collagen is also used for various biomedical applications.
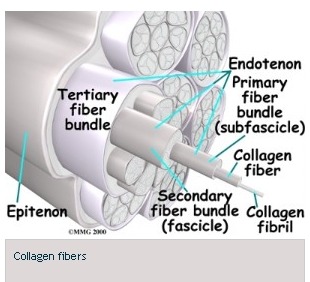
The epitenon is one of two major components in the covers of tendons. It is the loose connective tissue sheath covering a tendon over its entire length. It contains a few fibroblast-like cells, blood and lymphatic vessels and anerve supply. The other portion, the endotenon, covers the inside portions of the tendon such as the fascicle, subfasicle, and tertiary fiber bundle structure.
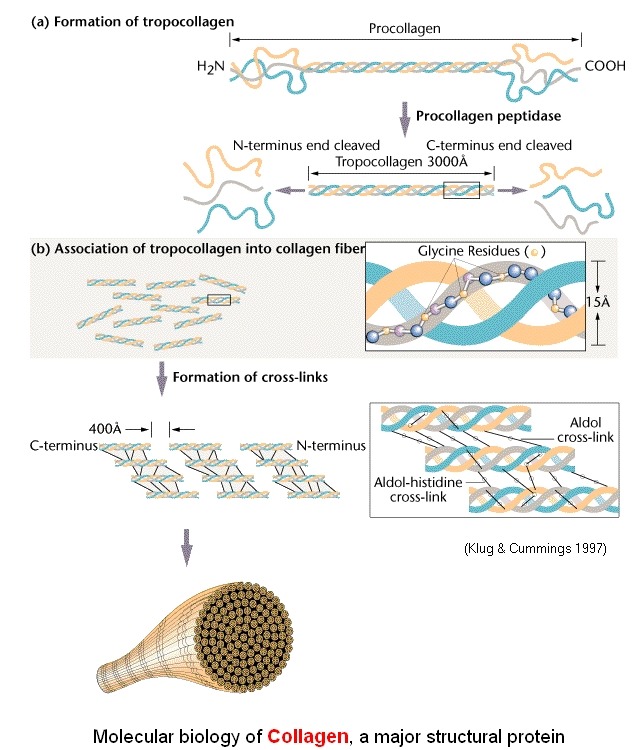
2) 프로테오글리칸
- 연골에는 많은 형태의 프로테오글리칸이 있다. 근본적으로 이는 하나 또는 그 이상의 글리코스아미노클리칸(GAGs)에 부착된 중심단백질로 이루어진 큰 단백질-다당류 분자이다.


Functions of Proteoglycans
Proteoglycans may be soluble and located in the extracellular matrix, as is the case for serglycin , versican , and the cartilage matrix proteoglycan , or they may be integral transmembrane proteins, such as syndecan .
Both types of proteoglycan appear to function by interacting with a variety of other molecules through their glycosaminoglycan components and through specific receptor domains in the polypeptide itself.
For example, syndecan (from the Greek syndein meaning “to bind together”) is a transmembrane proteoglycan that associates intracellularly with the actin cytoskeleton (Chapter 17). Outside the cell, it interacts with fibronectin , an extracellular protein that binds to several cell surface proteins and to components of the extracellular matrix.
The ability of syndecan to participate in multiple interactions with these target molecules allows them to act as a sort of “glue” in the extracellular space, linking components of the extracellular matrix, facilitating the binding of cells to the matrix, and mediating the binding of growth factors and other soluble molecules to the matrix and to cell surfaces (Figure 9.32).
Figure 9.32 · Proteoglycans serve a variety of functions on the cytoplasmic and extracellular surfaces of the plasma membrane. Many of these functions appear to involve the binding of specific proteins to the glycosaminoglycan groups.
Many of the functions of proteoglycans involve the binding of specific proteins to the glycosaminoglycan groups of the proteoglycan . The glycosaminoglycan binding sites on these specific proteins contain multiple basic amino acid residues. The amino acid sequences BBXB and BBBXXB (where B is a basic amino acid and X is any amino acid) recur repeatedly in these binding domains. Basic amino acids such as lysine and arginine provide charge neutralization for the negative charges of glycosaminoglycan residues, and in many cases, the binding of extracellular matrix proteins to glycosaminoglycans is primarily charge-dependent.
For example, more highly sulfated glycosaminoglycans bind more tightly to fibronectin . Certain protein- glycosaminoglycan interactions, however, require a specific carbohydrate sequence. A particular pentasaccharide sequence in heparin, for example, binds tightly to antithrombin III (Figure 9.33), accounting for the anticoagulant properties of heparin. Other glycosaminoglycans interact much more weakly.
Figure 9.33 · A portion of the structure of heparin, a carbohydrate having anticoagulant properties. It is used by blood banks to prevent the clotting of blood during donation and storage and also by physicians to prevent the formation of life-threatening blood clots in patients recovering from serious injury or surgery. This sulfated pentasaccharide sequence in heparin binds with high affinity to antithrombin III, accounting for this anticoagulant activity. The 3-O-sulfate marked by an asterisk is essential for high-affinity binding of heparin to antithrombin III.
Proteoglycans May Modulate Cell Growth Processes
Several lines of evidence raise the possibility of modulation or regulation of cell growth processes by proteoglycans .
First, heparin and heparan sulfate are known to inhibit cell proliferation in a process involving internalization of the glycosaminoglycan moiety and its migration to the cell nucleus.
Second, fibro-blast growth factor binds tightly to heparin and other glycosaminoglycans , and the heparin - growth factor complex protects the growth factor from degradative enzymes, thus enhancing its activity. There is evidence that binding of fibro-blast growth factors by proteoglycans and glycosaminoglycans in the extracellular matrix creates a reservoir of growth factors for cells to use.
Third, transforming growth factor β has been shown to stimulate the synthesis and secretion of proteoglycans in certain cells.
Fourth, several proteoglycan core proteins, including versican and lymphocyte homing receptor, have domains similar in sequence to epidermal growth factor and complement regulatory factor. These growth factor domains may interact specifically with growth factor receptors in the cell membrane in processes that are not yet understood.
Proteoglycans Make Cartilage Flexible and Resilient
Cartilage matrix proteoglycan is responsible for the flexibility and resilience of cartilage tissue in the body. In cartilage, long filaments of hyaluronic acid are studded or coated with proteoglycan molecules, as shown in Figure 9.34. The hyaluronate chains can be as long as 4 μm and can coordinate 100 or more proteoglycan units. Cartilage proteoglycan possesses a hyaluronic acid binding domain on the NH2-terminal portion of the polypeptide, which binds to hyaluronate with the assistance of a link protein.The proteoglycan - hyaluronate aggregates can have molecular weights of 2 million or more.
Figure 9.34 · Hyaluronate (see Figure 7.33) forms the backbone of proteoglycan structures, such as those found in cartilage. The proteoglycan subunits consist of a core protein containing numerous O-linked and N-linked glycosaminoglycans. In cartilage, these highly hydrated proteoglycan structures are enmeshed in a network of collagen fibers. Release (and subsequent reabsorption) of water by these structures during compression accounts for the shock-absorbing qualities of cartilaginous tissue.
The proteoglycan - hyaluronate aggregates are highly hydrated by virtue of strong interactions between water molecules and the polyanionic complex.
When cartilage is compressed (such as when joints absorb the impact of walking or running), water is briefly squeezed out of the cartilage tissue and then reabsorbed when the stress is diminished. This reversible hydration gives cartilage its flexible, shock-absorbing qualities and cushions the joints during physical activities that might otherwise injure the involved tissues.
3) 물(water)
- 관절 연골의 가장 풍부한 구성요소인 물은 관절 표면근처에 대부분 집중. 물은 연골의 역학적이고 생리 화학적인 반응에 큰 영향을 미치는 자유 움직임 양이온(Na, K, Ca+)을 포함.
- 관절연골의 액체성분은 연골세포와 주변의 영양이 풍부한 활액간의 가스, 영양분, 그리고 노폐물의 출입운동을 허용함으로써 이 무혈관성 조직의 건강에 필수적
- 연골에서는 작은 비율의 물만이 세포내에 존재하며 약 30%는 교원섬유와 강하게 연결. 물과의 사이에 돈난 산투압을 통해 상호작용함으로써 ECM의 구조적 구성과 그것의 부종특성을 조절하는 중요한 기능.
생체역학은 생체공학과 생체 의공학의 한 분야다. 생체역학은 정역학과 동역학으로 나뉜다. 정역학의 원리는 근골격 시스템 가운데 여러관절과 근육속에 관계하고 있는 힘의 성질과 크기를 분석하기 위해 적용되어져 왔다. 동역학의 원리는 운동기술 분석, 보행분석, 분절운동 분석 그리고 운동역학 분야에서 많이 적용된다.
생체역학에 관한 실험적 연구는 뼈, 연골, 근육, 건, 인대, 피부와 혈액을 포함하는 전체 또는 그들을 구성하고 있는 일부의 생물학적 요소에 대해 역학적 특성을 규명하기 위해 이루어진다.
제 1장. 생체역학의 개요. 용어와 개념
스칼라(scalar) - 스칼라는 오직 크기만을 가진 물리량(질량, 에너지, 힘, 온도, 기계적인 일)
벡터(vector) - 크기와 방향을 포함하는 물리양(모멘트, 속도, 가속도)
텐서(tensor) - 스칼라는 0 tensor, 벡터는 first-order tensor, 변형력(stress) 변형(strains)은 second-order tensor
토크(torque) - 토크는 회전운동과 비트는 동작에 작용하는 힘
모멘트(moment) - 구부리는 동작과 연관된 힘. 무멘트와 토크의 수학적 정의는 동일한 것다. 토크와 모멘트 역시 벡터량이다.
free-body diagrams 다음에 정확히 이해해야
정역학의 목적에 대한 질문
# 어떤 자세에서 머리를 지지하기 위하여 관련된 목의 어떤 신전근이 작용해야만 하는가?
# 어떤 사람이 구부리고 있을때 제5번 요추골위에서 척추기립근에 의해서 발휘되는 힘은 무엇인가?
stress-strain diagram

탄성과 가소성 변형(elastic and plastic deformations)
- 탄성(elasticity)은 적용된 부하로 없어진 모양과 크기가 다시 원래의 모습을 찾는 능력
- 가소성(plasticity)은 물질이 그들의 탄성한계를 넘어서 부하를 줄때, 탄성적 변형을 따라 가소성 변형이 진행
점탄성(viscoelasticity)
- 점성(viscosity)는 액체물질의 특성으로 흐름에 대한 저항값이다. 탄성은 고체물질의 특성. 점탄성은 액체과 고체의 특성을 모두 개념이다. 점탄성의 성질을 가진 인체관절은 스트레스-이완실험에서 고체의 성질을 가진 탄성의 스트레스-이완실험과는 다른 결과를 나타낸다.

제 2장. 뼈의 생체역학
- 골격계는 내장기관을 보호하고, 단단한 운동링크(rigid kinematic links)와 근 부착점을 제공하며, 근활동과 인체 운동을 촉진하는 역할. 뼈는 인체에서 가장 견고한 구조물로 독특한 구조적, 역학적 특성을 가지고 자신의 역할을 수행
뼈의 성분과 구조
- 뼈조직은 지지와 보호역할에 적합한 고체성분의 특수한 결합조직(special connective tissue)
- 뼈는 다른 결합조직과 마찬가지로 섬유의 유기질인 세포외기질(extracellular matrix) 기질(ground substance), 세포로 구성
- 다른 결합조직과의 차이는 mineral salt 형태로 된 무기질을 많이가지고 있다는 것
- 뼈의 무기질(주로 칼슘과 인)은 뼈를 견고하게 하는 역할, 유기성분은 유연성과 탄성을 제공
- 건조중량의 60-70%에 해당하는 무기질은 뼈의 견고도를 제공, 뼈조직은 5-8%의 수분을 함유하고 있고 나머지는 유기질로 구성
- 뼈의 무기질은 여러방향으로 엉켜있는 세포외기질의 섬유인 collagen섬유속에 묻혀있다. collagen type1은 거칠고 유연하지만 신장력에 매우 약한 편이다. 세포외기질의 약 90%가 collagen으로 되어 있고, 뼈 건조중량의 25-50%가 교원질로 구성되어있다.
- 교원섬유를 둘러싸고 있는 젤성의 기질은 주로 다당류 단백이나 글라이코스아미노글리칸(GAGs)로 구성되어 있다 GAGs은 주로 프로테오글리칸이라는 거대분자 복합체의 형태로 되어있다. GAGs는 무기질의 고원섬유층 사이에서 고착화기질로 작용한다.
뼈에 가해지는 다양한 부하
- tension, compression, bending, shear, torsion, combined loading
다음에 다시 정리해야
제 3장. 관절연골의 생체역학
인체는 섬유성, 연골성, 활막성의 세가지 형태의 관절. 이중 활막성 관절만이 많은 움직임을 허용. 정상관절에서 가동관절의 골단은 초자연골(hyaline articular cartilage)이라는 얇고(1~6mm), 치밀하고, 방사선 투과성의 흰색 결합조직으로 덮여있다. 생화학적으로는 혈관, 림프관, 신경지배가 없는 분리된 조직.
가동관절의 관절 연골의 두가지 기능
첫째, 관절의 부하를 넓은 부위로 분산시켜 접촉하는 관절면의 스트레스 감소
둘째, 마주하고 있는 관절면이 마찰과 마모를 최소로 하면서 서로 움직이도록 하는 역할
읽을 논문

Regeneration and repair of tendon and ligament tissue using.pdf
관절연골의 구조와 조성
- 연골세포(chondrocyte)는 관절연골에서 성기게 분포한 세포로서 조직용적의 10%이하를 차지. 연골세포는 성긴 분포에도 불구하고 세포외 물질의 기질성분을 만들고 분비하며, 기질화를 유지. 기질성분은 프로테오글리칸 용액속에서 그물을 이루고 있는 미세한 교원섬유(대부분 2형 교원질이며, 다른형도 존재)의 조밀한 망으로 구성.
- 교원섬유와 PGs(프로테오글리칸)은 각각 상당한 강도의 구조적 망을 형성하는 것이 가능하여, 관절연골에 가해지는 부하로 인해 내부의 역학적 스트레스를 지지하는 구조적 구성성분


관절연골의 교원질은 3가지 층으로 구성(Mow 1974)
가) 표면접선층(superficial tangential zone)
- 전체 두깨의 10-20%, 관절표면과 평행하게 치밀하게 묶여진 섬유배열
나) 중간층(middle zone)
- 전체 두깨의 40-60%, 무작위 섬유배열
다) 심층(deep zone)
- 전체두깨의 30%, 섬유다발이 방사상배열, 이들 섬유다발은 관절연골과 그 아래 석회층 연골사이의 접점인 tidemark을 지나 뼈로 연결되어 연골과 뼈가 단단히 부착되도록 뿌리체계를 형성
- 이러한 비등방성의 섬유(anisotropic fiber) 배열은 관절조직의 부하를 받는 스트레스를 분산하는 중요한 생체역학적 기능제공
- 관절연골은 뼈와같이 물질적인 조성이 부하의 방향에 따라 달라지는 anisotropic이다. 비등방성은 관절연골의 평탄한 면에 다양한 교원질 섬유배열과 관계가 있다.

Schematic summarizing the macromolecular organization of mature articular cartilage. The tissue consists of four distinct zones: superficial (SZ); middle (MZ), deep (DZ), and a zone of calcified cartilage matrix (CZ), below which is the subchondral bone (SB). Each zone is distinct in terms of its cell morphology (left panel), collagen fiber organization (middle panel), and the biochemical composition of its extracellular matrix (ECM) (right panel). Matrix constituents of each cartilage zone are presented as molecular schematics.
1) 교원질(collagen)
- 관절연골에서 교원질(collagen)은 섬유성의 초미세구조인 고도의 구조적 구성물을 구성.
- 연골은 주로 2형 교원질로 이루어져 있다. 추가로 다른 교원질은 관절연골내에 적은 양이 배열되어 있다. 2형교원질은 주로 고나절연골, 비중격, 흉부연골뿐 아니라 추감판의 내측, 그리고 반월판에 존재.
- 1형 교원질은 인체에서 가장 풍족한 교원질이며, 뼈와 추간판(주로 수핵), 피부, 반월판, 건, 인대 등과 같은 연부조직에서 발견된다. 교원섬유의 가장 중요한 역학적 특성은 장력과 힘이다. 교원섬유는 장력(tension)에는 견고하고 강하지만 압박에는 쉽게 휘어지는 특성이 있다.
- 여러가지 신체조직에서 모교원질 알파사슬의 차이에 따라 특정 분자의 종류나 교원질의 형태를 나타낸다. 초자연골에 있는 2형 교원질은 뼈, 인대, 건에 있는 1형 교원질과는 다르다. 2형교원질은 1형 교원질보다는 섬유가 더 가늘기 때문에 교원질이 연골조직 전체에 최대로 흩어져 있을 수 있다.
참고) 교원질 형태차이
- 여러가지 신체조직에서 모교원질 알파사슬의 차이에 따라 특정분자의 종류나 교원질의 형태를 나타낸다. 초자연골에 있는 2형 교원질은 뼈, 인대, 그리고 건에 있는 1형 교원질과는 다르다. 2형 교원질은 1형 보다는 섬유가 더 가늘기 때문에 교원질이 연골조직 전체에 최대로 흩어져 있을 수 있다.
Collagen is a family of proteins; in animals these proteins play critical roles in tissue architecture, tissue strength, and cell to cell relationships. The major component of all connective tissue matrixes, collagen is found in tissues such as skin, blood vessels, bone, tendon, and ligament, and is characterized by tremendous strength.
The word "collagen" derives from the Greek word for "glue"; this derivation is based on the observation that insoluble collagen, when heated in water, becomes soluble, gummy gelatin that can be used in the manufacture of glues or as a thickener in foods. There are ten known forms of collagen that, because of differences in functional requirements and chemical environments, differ in some details of composition.
An individual collagen polypeptide chain has a large number of repeating amino acid sequences, most often glycine–X–Y, where X is often proline and Y is often hydroxyproline. Lysine, in its pure form or modified to hydroxylysine, is also found in collagen. Both hydroxyproline and hydroxylysine are formed via the enzyme-catalyzed oxidations of the proline and lysine amino acid side chains, which occur after the collagen polypeptide has been synthesized. These enzymatic reactions require ascorbic acid ( vitamin C) as a cofactor .

Individual collagen polypeptides form an extended, left-handed triple helix, which is longer and less compact than the α -helixes often seen in proteins. Three of these helixes then form a molecule of tropocollagen , the basic building block of collagen, by coiling around a central axis in a right-handed, triple-helical arrangement. The side chain of every third amino acid is very close to the central axis of this superhelix . Glycine, with the smallest side chain of any amino acid, is more easily accommodated in these arrangements than the larger, bulkier amino acids.
Tropocollagen molecules associate in a staggered fashion to form collagen fibrils , which are stronger than steel wire of similar size. Collagen fibrils are strengthened and stabilized mainly by covalent cross-links, existing both within and between individual tropocollagen molecules. These crosslinks represent the enzyme-catalyzed formation of covalent bonds involving lysine and hydroxylysine side chains. The extent of cross-linking depends on the specific function of the collagen molecule involved and the age of the animal; older animals have more highly cross-linked and therefore more rigid collagen.
There are a number of collagen-related disorders that have been identified. Many of these are the result of derangements in the biosynthesis of collagen. Scurvy, characterized by bleeding gums, loose teeth, skin lesions, and weakened blood vessels, results from severe vitamin C deficiency, which makes it almost impossible for afflicted individuals to form hydroxyproline and hydroxylysine. The conditions, known collectively as the Ehlers–Danlo syndromes, result from defects in the processing of collagen polypeptides.
In addition to its importance in the production of animal glue, collagen is the basis for gelatin, which forms when collagen fibers are denatured as a result of heating and then get tangled up with each other. Collagen is also used for various biomedical applications.

The epitenon is one of two major components in the covers of tendons. It is the loose connective tissue sheath covering a tendon over its entire length. It contains a few fibroblast-like cells, blood and lymphatic vessels and anerve supply. The other portion, the endotenon, covers the inside portions of the tendon such as the fascicle, subfasicle, and tertiary fiber bundle structure.

2) 프로테오글리칸
- 연골에는 많은 형태의 프로테오글리칸이 있다. 근본적으로 이는 하나 또는 그 이상의 글리코스아미노클리칸(GAGs)에 부착된 중심단백질로 이루어진 큰 단백질-다당류 분자이다.


Functions of Proteoglycans
Proteoglycans may be soluble and located in the extracellular matrix, as is the case for serglycin , versican , and the cartilage matrix proteoglycan , or they may be integral transmembrane proteins, such as syndecan .
Both types of proteoglycan appear to function by interacting with a variety of other molecules through their glycosaminoglycan components and through specific receptor domains in the polypeptide itself.
For example, syndecan (from the Greek syndein meaning “to bind together”) is a transmembrane proteoglycan that associates intracellularly with the actin cytoskeleton (Chapter 17). Outside the cell, it interacts with fibronectin , an extracellular protein that binds to several cell surface proteins and to components of the extracellular matrix.
The ability of syndecan to participate in multiple interactions with these target molecules allows them to act as a sort of “glue” in the extracellular space, linking components of the extracellular matrix, facilitating the binding of cells to the matrix, and mediating the binding of growth factors and other soluble molecules to the matrix and to cell surfaces (Figure 9.32).
Figure 9.32 · Proteoglycans serve a variety of functions on the cytoplasmic and extracellular surfaces of the plasma membrane. Many of these functions appear to involve the binding of specific proteins to the glycosaminoglycan groups.
Many of the functions of proteoglycans involve the binding of specific proteins to the glycosaminoglycan groups of the proteoglycan . The glycosaminoglycan binding sites on these specific proteins contain multiple basic amino acid residues. The amino acid sequences BBXB and BBBXXB (where B is a basic amino acid and X is any amino acid) recur repeatedly in these binding domains. Basic amino acids such as lysine and arginine provide charge neutralization for the negative charges of glycosaminoglycan residues, and in many cases, the binding of extracellular matrix proteins to glycosaminoglycans is primarily charge-dependent.
For example, more highly sulfated glycosaminoglycans bind more tightly to fibronectin . Certain protein- glycosaminoglycan interactions, however, require a specific carbohydrate sequence. A particular pentasaccharide sequence in heparin, for example, binds tightly to antithrombin III (Figure 9.33), accounting for the anticoagulant properties of heparin. Other glycosaminoglycans interact much more weakly.
Figure 9.33 · A portion of the structure of heparin, a carbohydrate having anticoagulant properties. It is used by blood banks to prevent the clotting of blood during donation and storage and also by physicians to prevent the formation of life-threatening blood clots in patients recovering from serious injury or surgery. This sulfated pentasaccharide sequence in heparin binds with high affinity to antithrombin III, accounting for this anticoagulant activity. The 3-O-sulfate marked by an asterisk is essential for high-affinity binding of heparin to antithrombin III.
Proteoglycans May Modulate Cell Growth Processes
Several lines of evidence raise the possibility of modulation or regulation of cell growth processes by proteoglycans .
First, heparin and heparan sulfate are known to inhibit cell proliferation in a process involving internalization of the glycosaminoglycan moiety and its migration to the cell nucleus.
Second, fibro-blast growth factor binds tightly to heparin and other glycosaminoglycans , and the heparin - growth factor complex protects the growth factor from degradative enzymes, thus enhancing its activity. There is evidence that binding of fibro-blast growth factors by proteoglycans and glycosaminoglycans in the extracellular matrix creates a reservoir of growth factors for cells to use.
Third, transforming growth factor β has been shown to stimulate the synthesis and secretion of proteoglycans in certain cells.
Fourth, several proteoglycan core proteins, including versican and lymphocyte homing receptor, have domains similar in sequence to epidermal growth factor and complement regulatory factor. These growth factor domains may interact specifically with growth factor receptors in the cell membrane in processes that are not yet understood.
Proteoglycans Make Cartilage Flexible and Resilient
Cartilage matrix proteoglycan is responsible for the flexibility and resilience of cartilage tissue in the body. In cartilage, long filaments of hyaluronic acid are studded or coated with proteoglycan molecules, as shown in Figure 9.34. The hyaluronate chains can be as long as 4 μm and can coordinate 100 or more proteoglycan units. Cartilage proteoglycan possesses a hyaluronic acid binding domain on the NH2-terminal portion of the polypeptide, which binds to hyaluronate with the assistance of a link protein.The proteoglycan - hyaluronate aggregates can have molecular weights of 2 million or more.
Figure 9.34 · Hyaluronate (see Figure 7.33) forms the backbone of proteoglycan structures, such as those found in cartilage. The proteoglycan subunits consist of a core protein containing numerous O-linked and N-linked glycosaminoglycans. In cartilage, these highly hydrated proteoglycan structures are enmeshed in a network of collagen fibers. Release (and subsequent reabsorption) of water by these structures during compression accounts for the shock-absorbing qualities of cartilaginous tissue.
The proteoglycan - hyaluronate aggregates are highly hydrated by virtue of strong interactions between water molecules and the polyanionic complex.
When cartilage is compressed (such as when joints absorb the impact of walking or running), water is briefly squeezed out of the cartilage tissue and then reabsorbed when the stress is diminished. This reversible hydration gives cartilage its flexible, shock-absorbing qualities and cushions the joints during physical activities that might otherwise injure the involved tissues.
3) 물(water)
- 관절 연골의 가장 풍부한 구성요소인 물은 관절 표면근처에 대부분 집중. 물은 연골의 역학적이고 생리 화학적인 반응에 큰 영향을 미치는 자유 움직임 양이온(Na, K, Ca+)을 포함.
- 관절연골의 액체성분은 연골세포와 주변의 영양이 풍부한 활액간의 가스, 영양분, 그리고 노폐물의 출입운동을 허용함으로써 이 무혈관성 조직의 건강에 필수적
- 연골에서는 작은 비율의 물만이 세포내에 존재하며 약 30%는 교원섬유와 강하게 연결. 물과의 사이에 돈난 산투압을 통해 상호작용함으로써 ECM의 구조적 구성과 그것의 부종특성을 조절하는 중요한 기능.
생체역학은 생체공학과 생체 의공학의 한 분야다. 생체역학은 정역학과 동역학으로 나뉜다. 정역학의 원리는 근골격 시스템 가운데 여러관절과 근육속에 관계하고 있는 힘의 성질과 크기를 분석하기 위해 적용되어져 왔다. 동역학의 원리는 운동기술 분석, 보행분석, 분절운동 분석 그리고 운동역학 분야에서 많이 적용된다.
생체역학에 관한 실험적 연구는 뼈, 연골, 근육, 건, 인대, 피부와 혈액을 포함하는 전체 또는 그들을 구성하고 있는 일부의 생물학적 요소에 대해 역학적 특성을 규명하기 위해 이루어진다.
제 1장. 생체역학의 개요. 용어와 개념
스칼라(scalar) - 스칼라는 오직 크기만을 가진 물리량(질량, 에너지, 힘, 온도, 기계적인 일)
벡터(vector) - 크기와 방향을 포함하는 물리양(모멘트, 속도, 가속도)
텐서(tensor) - 스칼라는 0 tensor, 벡터는 first-order tensor, 변형력(stress) 변형(strains)은 second-order tensor
토크(torque) - 토크는 회전운동과 비트는 동작에 작용하는 힘
모멘트(moment) - 구부리는 동작과 연관된 힘. 무멘트와 토크의 수학적 정의는 동일한 것다. 토크와 모멘트 역시 벡터량이다.
free-body diagrams 다음에 정확히 이해해야
정역학의 목적에 대한 질문
# 어떤 자세에서 머리를 지지하기 위하여 관련된 목의 어떤 신전근이 작용해야만 하는가?
# 어떤 사람이 구부리고 있을때 제5번 요추골위에서 척추기립근에 의해서 발휘되는 힘은 무엇인가?
stress-strain diagram

탄성과 가소성 변형(elastic and plastic deformations)
- 탄성(elasticity)은 적용된 부하로 없어진 모양과 크기가 다시 원래의 모습을 찾는 능력
- 가소성(plasticity)은 물질이 그들의 탄성한계를 넘어서 부하를 줄때, 탄성적 변형을 따라 가소성 변형이 진행
점탄성(viscoelasticity)
- 점성(viscosity)는 액체물질의 특성으로 흐름에 대한 저항값이다. 탄성은 고체물질의 특성. 점탄성은 액체과 고체의 특성을 모두 개념이다. 점탄성의 성질을 가진 인체관절은 스트레스-이완실험에서 고체의 성질을 가진 탄성의 스트레스-이완실험과는 다른 결과를 나타낸다.

제 2장. 뼈의 생체역학
- 골격계는 내장기관을 보호하고, 단단한 운동링크(rigid kinematic links)와 근 부착점을 제공하며, 근활동과 인체 운동을 촉진하는 역할. 뼈는 인체에서 가장 견고한 구조물로 독특한 구조적, 역학적 특성을 가지고 자신의 역할을 수행
뼈의 성분과 구조
- 뼈조직은 지지와 보호역할에 적합한 고체성분의 특수한 결합조직(special connective tissue)
- 뼈는 다른 결합조직과 마찬가지로 섬유의 유기질인 세포외기질(extracellular matrix) 기질(ground substance), 세포로 구성
- 다른 결합조직과의 차이는 mineral salt 형태로 된 무기질을 많이가지고 있다는 것
- 뼈의 무기질(주로 칼슘과 인)은 뼈를 견고하게 하는 역할, 유기성분은 유연성과 탄성을 제공
- 건조중량의 60-70%에 해당하는 무기질은 뼈의 견고도를 제공, 뼈조직은 5-8%의 수분을 함유하고 있고 나머지는 유기질로 구성
- 뼈의 무기질은 여러방향으로 엉켜있는 세포외기질의 섬유인 collagen섬유속에 묻혀있다. collagen type1은 거칠고 유연하지만 신장력에 매우 약한 편이다. 세포외기질의 약 90%가 collagen으로 되어 있고, 뼈 건조중량의 25-50%가 교원질로 구성되어있다.
- 교원섬유를 둘러싸고 있는 젤성의 기질은 주로 다당류 단백이나 글라이코스아미노글리칸(GAGs)로 구성되어 있다 GAGs은 주로 프로테오글리칸이라는 거대분자 복합체의 형태로 되어있다. GAGs는 무기질의 고원섬유층 사이에서 고착화기질로 작용한다.
뼈에 가해지는 다양한 부하
- tension, compression, bending, shear, torsion, combined loading
다음에 다시 정리해야
제 3장. 관절연골의 생체역학
인체는 섬유성, 연골성, 활막성의 세가지 형태의 관절. 이중 활막성 관절만이 많은 움직임을 허용. 정상관절에서 가동관절의 골단은 초자연골(hyaline articular cartilage)이라는 얇고(1~6mm), 치밀하고, 방사선 투과성의 흰색 결합조직으로 덮여있다. 생화학적으로는 혈관, 림프관, 신경지배가 없는 분리된 조직.
가동관절의 관절 연골의 두가지 기능
첫째, 관절의 부하를 넓은 부위로 분산시켜 접촉하는 관절면의 스트레스 감소
둘째, 마주하고 있는 관절면이 마찰과 마모를 최소로 하면서 서로 움직이도록 하는 역할
읽을 논문

Regeneration and repair of tendon and ligament tissue using.pdf
관절연골의 구조와 조성
- 연골세포(chondrocyte)는 관절연골에서 성기게 분포한 세포로서 조직용적의 10%이하를 차지. 연골세포는 성긴 분포에도 불구하고 세포외 물질의 기질성분을 만들고 분비하며, 기질화를 유지. 기질성분은 프로테오글리칸 용액속에서 그물을 이루고 있는 미세한 교원섬유(대부분 2형 교원질이며, 다른형도 존재)의 조밀한 망으로 구성.
- 교원섬유와 PGs(프로테오글리칸)은 각각 상당한 강도의 구조적 망을 형성하는 것이 가능하여, 관절연골에 가해지는 부하로 인해 내부의 역학적 스트레스를 지지하는 구조적 구성성분


관절연골의 교원질은 3가지 층으로 구성(Mow 1974)
가) 표면접선층(superficial tangential zone)
- 전체 두깨의 10-20%, 관절표면과 평행하게 치밀하게 묶여진 섬유배열
나) 중간층(middle zone)
- 전체 두깨의 40-60%, 무작위 섬유배열
다) 심층(deep zone)
- 전체두깨의 30%, 섬유다발이 방사상배열, 이들 섬유다발은 관절연골과 그 아래 석회층 연골사이의 접점인 tidemark을 지나 뼈로 연결되어 연골과 뼈가 단단히 부착되도록 뿌리체계를 형성
- 이러한 비등방성의 섬유(anisotropic fiber) 배열은 관절조직의 부하를 받는 스트레스를 분산하는 중요한 생체역학적 기능제공
- 관절연골은 뼈와같이 물질적인 조성이 부하의 방향에 따라 달라지는 anisotropic이다. 비등방성은 관절연골의 평탄한 면에 다양한 교원질 섬유배열과 관계가 있다.

Schematic summarizing the macromolecular organization of mature articular cartilage. The tissue consists of four distinct zones: superficial (SZ); middle (MZ), deep (DZ), and a zone of calcified cartilage matrix (CZ), below which is the subchondral bone (SB). Each zone is distinct in terms of its cell morphology (left panel), collagen fiber organization (middle panel), and the biochemical composition of its extracellular matrix (ECM) (right panel). Matrix constituents of each cartilage zone are presented as molecular schematics.
1) 교원질(collagen)
- 관절연골에서 교원질(collagen)은 섬유성의 초미세구조인 고도의 구조적 구성물을 구성.
- 연골은 주로 2형 교원질로 이루어져 있다. 추가로 다른 교원질은 관절연골내에 적은 양이 배열되어 있다. 2형교원질은 주로 고나절연골, 비중격, 흉부연골뿐 아니라 추감판의 내측, 그리고 반월판에 존재.
- 1형 교원질은 인체에서 가장 풍족한 교원질이며, 뼈와 추간판(주로 수핵), 피부, 반월판, 건, 인대 등과 같은 연부조직에서 발견된다. 교원섬유의 가장 중요한 역학적 특성은 장력과 힘이다. 교원섬유는 장력(tension)에는 견고하고 강하지만 압박에는 쉽게 휘어지는 특성이 있다.
- 여러가지 신체조직에서 모교원질 알파사슬의 차이에 따라 특정 분자의 종류나 교원질의 형태를 나타낸다. 초자연골에 있는 2형 교원질은 뼈, 인대, 건에 있는 1형 교원질과는 다르다. 2형교원질은 1형 교원질보다는 섬유가 더 가늘기 때문에 교원질이 연골조직 전체에 최대로 흩어져 있을 수 있다.
참고) 교원질 형태차이
- 여러가지 신체조직에서 모교원질 알파사슬의 차이에 따라 특정분자의 종류나 교원질의 형태를 나타낸다. 초자연골에 있는 2형 교원질은 뼈, 인대, 그리고 건에 있는 1형 교원질과는 다르다. 2형 교원질은 1형 보다는 섬유가 더 가늘기 때문에 교원질이 연골조직 전체에 최대로 흩어져 있을 수 있다.
Collagen is a family of proteins; in animals these proteins play critical roles in tissue architecture, tissue strength, and cell to cell relationships. The major component of all connective tissue matrixes, collagen is found in tissues such as skin, blood vessels, bone, tendon, and ligament, and is characterized by tremendous strength.
The word "collagen" derives from the Greek word for "glue"; this derivation is based on the observation that insoluble collagen, when heated in water, becomes soluble, gummy gelatin that can be used in the manufacture of glues or as a thickener in foods. There are ten known forms of collagen that, because of differences in functional requirements and chemical environments, differ in some details of composition.
An individual collagen polypeptide chain has a large number of repeating amino acid sequences, most often glycine–X–Y, where X is often proline and Y is often hydroxyproline. Lysine, in its pure form or modified to hydroxylysine, is also found in collagen. Both hydroxyproline and hydroxylysine are formed via the enzyme-catalyzed oxidations of the proline and lysine amino acid side chains, which occur after the collagen polypeptide has been synthesized. These enzymatic reactions require ascorbic acid ( vitamin C) as a cofactor .

Individual collagen polypeptides form an extended, left-handed triple helix, which is longer and less compact than the α -helixes often seen in proteins. Three of these helixes then form a molecule of tropocollagen , the basic building block of collagen, by coiling around a central axis in a right-handed, triple-helical arrangement. The side chain of every third amino acid is very close to the central axis of this superhelix . Glycine, with the smallest side chain of any amino acid, is more easily accommodated in these arrangements than the larger, bulkier amino acids.
Tropocollagen molecules associate in a staggered fashion to form collagen fibrils , which are stronger than steel wire of similar size. Collagen fibrils are strengthened and stabilized mainly by covalent cross-links, existing both within and between individual tropocollagen molecules. These crosslinks represent the enzyme-catalyzed formation of covalent bonds involving lysine and hydroxylysine side chains. The extent of cross-linking depends on the specific function of the collagen molecule involved and the age of the animal; older animals have more highly cross-linked and therefore more rigid collagen.
There are a number of collagen-related disorders that have been identified. Many of these are the result of derangements in the biosynthesis of collagen. Scurvy, characterized by bleeding gums, loose teeth, skin lesions, and weakened blood vessels, results from severe vitamin C deficiency, which makes it almost impossible for afflicted individuals to form hydroxyproline and hydroxylysine. The conditions, known collectively as the Ehlers–Danlo syndromes, result from defects in the processing of collagen polypeptides.
In addition to its importance in the production of animal glue, collagen is the basis for gelatin, which forms when collagen fibers are denatured as a result of heating and then get tangled up with each other. Collagen is also used for various biomedical applications.

The epitenon is one of two major components in the covers of tendons. It is the loose connective tissue sheath covering a tendon over its entire length. It contains a few fibroblast-like cells, blood and lymphatic vessels and anerve supply. The other portion, the endotenon, covers the inside portions of the tendon such as the fascicle, subfasicle, and tertiary fiber bundle structure.

2) 프로테오글리칸
- 연골에는 많은 형태의 프로테오글리칸이 있다. 근본적으로 이는 하나 또는 그 이상의 글리코스아미노클리칸(GAGs)에 부착된 중심단백질로 이루어진 큰 단백질-다당류 분자이다.


Functions of Proteoglycans
Proteoglycans may be soluble and located in the extracellular matrix, as is the case for serglycin , versican , and the cartilage matrix proteoglycan , or they may be integral transmembrane proteins, such as syndecan .
Both types of proteoglycan appear to function by interacting with a variety of other molecules through their glycosaminoglycan components and through specific receptor domains in the polypeptide itself.
For example, syndecan (from the Greek syndein meaning “to bind together”) is a transmembrane proteoglycan that associates intracellularly with the actin cytoskeleton (Chapter 17). Outside the cell, it interacts with fibronectin , an extracellular protein that binds to several cell surface proteins and to components of the extracellular matrix.
The ability of syndecan to participate in multiple interactions with these target molecules allows them to act as a sort of “glue” in the extracellular space, linking components of the extracellular matrix, facilitating the binding of cells to the matrix, and mediating the binding of growth factors and other soluble molecules to the matrix and to cell surfaces (Figure 9.32).
Figure 9.32 · Proteoglycans serve a variety of functions on the cytoplasmic and extracellular surfaces of the plasma membrane. Many of these functions appear to involve the binding of specific proteins to the glycosaminoglycan groups.
Many of the functions of proteoglycans involve the binding of specific proteins to the glycosaminoglycan groups of the proteoglycan . The glycosaminoglycan binding sites on these specific proteins contain multiple basic amino acid residues. The amino acid sequences BBXB and BBBXXB (where B is a basic amino acid and X is any amino acid) recur repeatedly in these binding domains. Basic amino acids such as lysine and arginine provide charge neutralization for the negative charges of glycosaminoglycan residues, and in many cases, the binding of extracellular matrix proteins to glycosaminoglycans is primarily charge-dependent.
For example, more highly sulfated glycosaminoglycans bind more tightly to fibronectin . Certain protein- glycosaminoglycan interactions, however, require a specific carbohydrate sequence. A particular pentasaccharide sequence in heparin, for example, binds tightly to antithrombin III (Figure 9.33), accounting for the anticoagulant properties of heparin. Other glycosaminoglycans interact much more weakly.
Figure 9.33 · A portion of the structure of heparin, a carbohydrate having anticoagulant properties. It is used by blood banks to prevent the clotting of blood during donation and storage and also by physicians to prevent the formation of life-threatening blood clots in patients recovering from serious injury or surgery. This sulfated pentasaccharide sequence in heparin binds with high affinity to antithrombin III, accounting for this anticoagulant activity. The 3-O-sulfate marked by an asterisk is essential for high-affinity binding of heparin to antithrombin III.
Proteoglycans May Modulate Cell Growth Processes
Several lines of evidence raise the possibility of modulation or regulation of cell growth processes by proteoglycans .
First, heparin and heparan sulfate are known to inhibit cell proliferation in a process involving internalization of the glycosaminoglycan moiety and its migration to the cell nucleus.
Second, fibro-blast growth factor binds tightly to heparin and other glycosaminoglycans , and the heparin - growth factor complex protects the growth factor from degradative enzymes, thus enhancing its activity. There is evidence that binding of fibro-blast growth factors by proteoglycans and glycosaminoglycans in the extracellular matrix creates a reservoir of growth factors for cells to use.
Third, transforming growth factor β has been shown to stimulate the synthesis and secretion of proteoglycans in certain cells.
Fourth, several proteoglycan core proteins, including versican and lymphocyte homing receptor, have domains similar in sequence to epidermal growth factor and complement regulatory factor. These growth factor domains may interact specifically with growth factor receptors in the cell membrane in processes that are not yet understood.
Proteoglycans Make Cartilage Flexible and Resilient
Cartilage matrix proteoglycan is responsible for the flexibility and resilience of cartilage tissue in the body. In cartilage, long filaments of hyaluronic acid are studded or coated with proteoglycan molecules, as shown in Figure 9.34. The hyaluronate chains can be as long as 4 μm and can coordinate 100 or more proteoglycan units. Cartilage proteoglycan possesses a hyaluronic acid binding domain on the NH2-terminal portion of the polypeptide, which binds to hyaluronate with the assistance of a link protein.The proteoglycan - hyaluronate aggregates can have molecular weights of 2 million or more.
Figure 9.34 · Hyaluronate (see Figure 7.33) forms the backbone of proteoglycan structures, such as those found in cartilage. The proteoglycan subunits consist of a core protein containing numerous O-linked and N-linked glycosaminoglycans. In cartilage, these highly hydrated proteoglycan structures are enmeshed in a network of collagen fibers. Release (and subsequent reabsorption) of water by these structures during compression accounts for the shock-absorbing qualities of cartilaginous tissue.
The proteoglycan - hyaluronate aggregates are highly hydrated by virtue of strong interactions between water molecules and the polyanionic complex.
When cartilage is compressed (such as when joints absorb the impact of walking or running), water is briefly squeezed out of the cartilage tissue and then reabsorbed when the stress is diminished. This reversible hydration gives cartilage its flexible, shock-absorbing qualities and cushions the joints during physical activities that might otherwise injure the involved tissues.
3) 물(water)
- 관절 연골의 가장 풍부한 구성요소인 물은 관절 표면근처에 대부분 집중. 물은 연골의 역학적이고 생리 화학적인 반응에 큰 영향을 미치는 자유 움직임 양이온(Na, K, Ca+)을 포함.
- 관절연골의 액체성분은 연골세포와 주변의 영양이 풍부한 활액간의 가스, 영양분, 그리고 노폐물의 출입운동을 허용함으로써 이 무혈관성 조직의 건강에 필수적
- 연골에서는 작은 비율의 물만이 세포내에 존재하며 약 30%는 교원섬유와 강하게 연결. 물과의 사이에 돈난 산투압을 통해 상호작용함으로써 ECM의 구조적 구성과 그것의 부종특성을 조절하는 중요한 기능.
생체역학은 생체공학과 생체 의공학의 한 분야다. 생체역학은 정역학과 동역학으로 나뉜다. 정역학의 원리는 근골격 시스템 가운데 여러관절과 근육속에 관계하고 있는 힘의 성질과 크기를 분석하기 위해 적용되어져 왔다. 동역학의 원리는 운동기술 분석, 보행분석, 분절운동 분석 그리고 운동역학 분야에서 많이 적용된다.
생체역학에 관한 실험적 연구는 뼈, 연골, 근육, 건, 인대, 피부와 혈액을 포함하는 전체 또는 그들을 구성하고 있는 일부의 생물학적 요소에 대해 역학적 특성을 규명하기 위해 이루어진다.
제 1장. 생체역학의 개요. 용어와 개념
스칼라(scalar) - 스칼라는 오직 크기만을 가진 물리량(질량, 에너지, 힘, 온도, 기계적인 일)
벡터(vector) - 크기와 방향을 포함하는 물리양(모멘트, 속도, 가속도)
텐서(tensor) - 스칼라는 0 tensor, 벡터는 first-order tensor, 변형력(stress) 변형(strains)은 second-order tensor
토크(torque) - 토크는 회전운동과 비트는 동작에 작용하는 힘
모멘트(moment) - 구부리는 동작과 연관된 힘. 무멘트와 토크의 수학적 정의는 동일한 것다. 토크와 모멘트 역시 벡터량이다.
free-body diagrams 다음에 정확히 이해해야
정역학의 목적에 대한 질문
# 어떤 자세에서 머리를 지지하기 위하여 관련된 목의 어떤 신전근이 작용해야만 하는가?
# 어떤 사람이 구부리고 있을때 제5번 요추골위에서 척추기립근에 의해서 발휘되는 힘은 무엇인가?
stress-strain diagram

탄성과 가소성 변형(elastic and plastic deformations)
- 탄성(elasticity)은 적용된 부하로 없어진 모양과 크기가 다시 원래의 모습을 찾는 능력
- 가소성(plasticity)은 물질이 그들의 탄성한계를 넘어서 부하를 줄때, 탄성적 변형을 따라 가소성 변형이 진행
점탄성(viscoelasticity)
- 점성(viscosity)는 액체물질의 특성으로 흐름에 대한 저항값이다. 탄성은 고체물질의 특성. 점탄성은 액체과 고체의 특성을 모두 개념이다. 점탄성의 성질을 가진 인체관절은 스트레스-이완실험에서 고체의 성질을 가진 탄성의 스트레스-이완실험과는 다른 결과를 나타낸다.

제 2장. 뼈의 생체역학
- 골격계는 내장기관을 보호하고, 단단한 운동링크(rigid kinematic links)와 근 부착점을 제공하며, 근활동과 인체 운동을 촉진하는 역할. 뼈는 인체에서 가장 견고한 구조물로 독특한 구조적, 역학적 특성을 가지고 자신의 역할을 수행
뼈의 성분과 구조
- 뼈조직은 지지와 보호역할에 적합한 고체성분의 특수한 결합조직(special connective tissue)
- 뼈는 다른 결합조직과 마찬가지로 섬유의 유기질인 세포외기질(extracellular matrix) 기질(ground substance), 세포로 구성
- 다른 결합조직과의 차이는 mineral salt 형태로 된 무기질을 많이가지고 있다는 것
- 뼈의 무기질(주로 칼슘과 인)은 뼈를 견고하게 하는 역할, 유기성분은 유연성과 탄성을 제공
- 건조중량의 60-70%에 해당하는 무기질은 뼈의 견고도를 제공, 뼈조직은 5-8%의 수분을 함유하고 있고 나머지는 유기질로 구성
- 뼈의 무기질은 여러방향으로 엉켜있는 세포외기질의 섬유인 collagen섬유속에 묻혀있다. collagen type1은 거칠고 유연하지만 신장력에 매우 약한 편이다. 세포외기질의 약 90%가 collagen으로 되어 있고, 뼈 건조중량의 25-50%가 교원질로 구성되어있다.
- 교원섬유를 둘러싸고 있는 젤성의 기질은 주로 다당류 단백이나 글라이코스아미노글리칸(GAGs)로 구성되어 있다 GAGs은 주로 프로테오글리칸이라는 거대분자 복합체의 형태로 되어있다. GAGs는 무기질의 고원섬유층 사이에서 고착화기질로 작용한다.
뼈에 가해지는 다양한 부하
- tension, compression, bending, shear, torsion, combined loading
다음에 다시 정리해야
제 3장. 관절연골의 생체역학
인체는 섬유성, 연골성, 활막성의 세가지 형태의 관절. 이중 활막성 관절만이 많은 움직임을 허용. 정상관절에서 가동관절의 골단은 초자연골(hyaline articular cartilage)이라는 얇고(1~6mm), 치밀하고, 방사선 투과성의 흰색 결합조직으로 덮여있다. 생화학적으로는 혈관, 림프관, 신경지배가 없는 분리된 조직.
가동관절의 관절 연골의 두가지 기능
첫째, 관절의 부하를 넓은 부위로 분산시켜 접촉하는 관절면의 스트레스 감소
둘째, 마주하고 있는 관절면이 마찰과 마모를 최소로 하면서 서로 움직이도록 하는 역할
읽을 논문

Regeneration and repair of tendon and ligament tissue using.pdf
관절연골의 구조와 조성
- 연골세포(chondrocyte)는 관절연골에서 성기게 분포한 세포로서 조직용적의 10%이하를 차지. 연골세포는 성긴 분포에도 불구하고 세포외 물질의 기질성분을 만들고 분비하며, 기질화를 유지. 기질성분은 프로테오글리칸 용액속에서 그물을 이루고 있는 미세한 교원섬유(대부분 2형 교원질이며, 다른형도 존재)의 조밀한 망으로 구성.
- 교원섬유와 PGs(프로테오글리칸)은 각각 상당한 강도의 구조적 망을 형성하는 것이 가능하여, 관절연골에 가해지는 부하로 인해 내부의 역학적 스트레스를 지지하는 구조적 구성성분


관절연골의 교원질은 3가지 층으로 구성(Mow 1974)
가) 표면접선층(superficial tangential zone)
- 전체 두깨의 10-20%, 관절표면과 평행하게 치밀하게 묶여진 섬유배열
나) 중간층(middle zone)
- 전체 두깨의 40-60%, 무작위 섬유배열
다) 심층(deep zone)
- 전체두깨의 30%, 섬유다발이 방사상배열, 이들 섬유다발은 관절연골과 그 아래 석회층 연골사이의 접점인 tidemark을 지나 뼈로 연결되어 연골과 뼈가 단단히 부착되도록 뿌리체계를 형성
- 이러한 비등방성의 섬유(anisotropic fiber) 배열은 관절조직의 부하를 받는 스트레스를 분산하는 중요한 생체역학적 기능제공
- 관절연골은 뼈와같이 물질적인 조성이 부하의 방향에 따라 달라지는 anisotropic이다. 비등방성은 관절연골의 평탄한 면에 다양한 교원질 섬유배열과 관계가 있다.

Schematic summarizing the macromolecular organization of mature articular cartilage. The tissue consists of four distinct zones: superficial (SZ); middle (MZ), deep (DZ), and a zone of calcified cartilage matrix (CZ), below which is the subchondral bone (SB). Each zone is distinct in terms of its cell morphology (left panel), collagen fiber organization (middle panel), and the biochemical composition of its extracellular matrix (ECM) (right panel). Matrix constituents of each cartilage zone are presented as molecular schematics.
1) 교원질(collagen)
- 관절연골에서 교원질(collagen)은 섬유성의 초미세구조인 고도의 구조적 구성물을 구성.
- 연골은 주로 2형 교원질로 이루어져 있다. 추가로 다른 교원질은 관절연골내에 적은 양이 배열되어 있다. 2형교원질은 주로 고나절연골, 비중격, 흉부연골뿐 아니라 추감판의 내측, 그리고 반월판에 존재.
- 1형 교원질은 인체에서 가장 풍족한 교원질이며, 뼈와 추간판(주로 수핵), 피부, 반월판, 건, 인대 등과 같은 연부조직에서 발견된다. 교원섬유의 가장 중요한 역학적 특성은 장력과 힘이다. 교원섬유는 장력(tension)에는 견고하고 강하지만 압박에는 쉽게 휘어지는 특성이 있다.
- 여러가지 신체조직에서 모교원질 알파사슬의 차이에 따라 특정 분자의 종류나 교원질의 형태를 나타낸다. 초자연골에 있는 2형 교원질은 뼈, 인대, 건에 있는 1형 교원질과는 다르다. 2형교원질은 1형 교원질보다는 섬유가 더 가늘기 때문에 교원질이 연골조직 전체에 최대로 흩어져 있을 수 있다.
참고) 교원질 형태차이
- 여러가지 신체조직에서 모교원질 알파사슬의 차이에 따라 특정분자의 종류나 교원질의 형태를 나타낸다. 초자연골에 있는 2형 교원질은 뼈, 인대, 그리고 건에 있는 1형 교원질과는 다르다. 2형 교원질은 1형 보다는 섬유가 더 가늘기 때문에 교원질이 연골조직 전체에 최대로 흩어져 있을 수 있다.
Collagen is a family of proteins; in animals these proteins play critical roles in tissue architecture, tissue strength, and cell to cell relationships. The major component of all connective tissue matrixes, collagen is found in tissues such as skin, blood vessels, bone, tendon, and ligament, and is characterized by tremendous strength.
The word "collagen" derives from the Greek word for "glue"; this derivation is based on the observation that insoluble collagen, when heated in water, becomes soluble, gummy gelatin that can be used in the manufacture of glues or as a thickener in foods. There are ten known forms of collagen that, because of differences in functional requirements and chemical environments, differ in some details of composition.
An individual collagen polypeptide chain has a large number of repeating amino acid sequences, most often glycine–X–Y, where X is often proline and Y is often hydroxyproline. Lysine, in its pure form or modified to hydroxylysine, is also found in collagen. Both hydroxyproline and hydroxylysine are formed via the enzyme-catalyzed oxidations of the proline and lysine amino acid side chains, which occur after the collagen polypeptide has been synthesized. These enzymatic reactions require ascorbic acid ( vitamin C) as a cofactor .

Individual collagen polypeptides form an extended, left-handed triple helix, which is longer and less compact than the α -helixes often seen in proteins. Three of these helixes then form a molecule of tropocollagen , the basic building block of collagen, by coiling around a central axis in a right-handed, triple-helical arrangement. The side chain of every third amino acid is very close to the central axis of this superhelix . Glycine, with the smallest side chain of any amino acid, is more easily accommodated in these arrangements than the larger, bulkier amino acids.
Tropocollagen molecules associate in a staggered fashion to form collagen fibrils , which are stronger than steel wire of similar size. Collagen fibrils are strengthened and stabilized mainly by covalent cross-links, existing both within and between individual tropocollagen molecules. These crosslinks represent the enzyme-catalyzed formation of covalent bonds involving lysine and hydroxylysine side chains. The extent of cross-linking depends on the specific function of the collagen molecule involved and the age of the animal; older animals have more highly cross-linked and therefore more rigid collagen.
There are a number of collagen-related disorders that have been identified. Many of these are the result of derangements in the biosynthesis of collagen. Scurvy, characterized by bleeding gums, loose teeth, skin lesions, and weakened blood vessels, results from severe vitamin C deficiency, which makes it almost impossible for afflicted individuals to form hydroxyproline and hydroxylysine. The conditions, known collectively as the Ehlers–Danlo syndromes, result from defects in the processing of collagen polypeptides.
In addition to its importance in the production of animal glue, collagen is the basis for gelatin, which forms when collagen fibers are denatured as a result of heating and then get tangled up with each other. Collagen is also used for various biomedical applications.

The epitenon is one of two major components in the covers of tendons. It is the loose connective tissue sheath covering a tendon over its entire length. It contains a few fibroblast-like cells, blood and lymphatic vessels and anerve supply. The other portion, the endotenon, covers the inside portions of the tendon such as the fascicle, subfasicle, and tertiary fiber bundle structure.

2) 프로테오글리칸
- 연골에는 많은 형태의 프로테오글리칸이 있다. 근본적으로 이는 하나 또는 그 이상의 글리코스아미노클리칸(GAGs)에 부착된 중심단백질로 이루어진 큰 단백질-다당류 분자이다.


Functions of Proteoglycans
Proteoglycans may be soluble and located in the extracellular matrix, as is the case for serglycin , versican , and the cartilage matrix proteoglycan , or they may be integral transmembrane proteins, such as syndecan .
Both types of proteoglycan appear to function by interacting with a variety of other molecules through their glycosaminoglycan components and through specific receptor domains in the polypeptide itself.
For example, syndecan (from the Greek syndein meaning “to bind together”) is a transmembrane proteoglycan that associates intracellularly with the actin cytoskeleton (Chapter 17). Outside the cell, it interacts with fibronectin , an extracellular protein that binds to several cell surface proteins and to components of the extracellular matrix.
The ability of syndecan to participate in multiple interactions with these target molecules allows them to act as a sort of “glue” in the extracellular space, linking components of the extracellular matrix, facilitating the binding of cells to the matrix, and mediating the binding of growth factors and other soluble molecules to the matrix and to cell surfaces (Figure 9.32).
Figure 9.32 · Proteoglycans serve a variety of functions on the cytoplasmic and extracellular surfaces of the plasma membrane. Many of these functions appear to involve the binding of specific proteins to the glycosaminoglycan groups.
Many of the functions of proteoglycans involve the binding of specific proteins to the glycosaminoglycan groups of the proteoglycan . The glycosaminoglycan binding sites on these specific proteins contain multiple basic amino acid residues. The amino acid sequences BBXB and BBBXXB (where B is a basic amino acid and X is any amino acid) recur repeatedly in these binding domains. Basic amino acids such as lysine and arginine provide charge neutralization for the negative charges of glycosaminoglycan residues, and in many cases, the binding of extracellular matrix proteins to glycosaminoglycans is primarily charge-dependent.
For example, more highly sulfated glycosaminoglycans bind more tightly to fibronectin . Certain protein- glycosaminoglycan interactions, however, require a specific carbohydrate sequence. A particular pentasaccharide sequence in heparin, for example, binds tightly to antithrombin III (Figure 9.33), accounting for the anticoagulant properties of heparin. Other glycosaminoglycans interact much more weakly.
Figure 9.33 · A portion of the structure of heparin, a carbohydrate having anticoagulant properties. It is used by blood banks to prevent the clotting of blood during donation and storage and also by physicians to prevent the formation of life-threatening blood clots in patients recovering from serious injury or surgery. This sulfated pentasaccharide sequence in heparin binds with high affinity to antithrombin III, accounting for this anticoagulant activity. The 3-O-sulfate marked by an asterisk is essential for high-affinity binding of heparin to antithrombin III.
Proteoglycans May Modulate Cell Growth Processes
Several lines of evidence raise the possibility of modulation or regulation of cell growth processes by proteoglycans .
First, heparin and heparan sulfate are known to inhibit cell proliferation in a process involving internalization of the glycosaminoglycan moiety and its migration to the cell nucleus.
Second, fibro-blast growth factor binds tightly to heparin and other glycosaminoglycans , and the heparin - growth factor complex protects the growth factor from degradative enzymes, thus enhancing its activity. There is evidence that binding of fibro-blast growth factors by proteoglycans and glycosaminoglycans in the extracellular matrix creates a reservoir of growth factors for cells to use.
Third, transforming growth factor β has been shown to stimulate the synthesis and secretion of proteoglycans in certain cells.
Fourth, several proteoglycan core proteins, including versican and lymphocyte homing receptor, have domains similar in sequence to epidermal growth factor and complement regulatory factor. These growth factor domains may interact specifically with growth factor receptors in the cell membrane in processes that are not yet understood.
Proteoglycans Make Cartilage Flexible and Resilient
Cartilage matrix proteoglycan is responsible for the flexibility and resilience of cartilage tissue in the body. In cartilage, long filaments of hyaluronic acid are studded or coated with proteoglycan molecules, as shown in Figure 9.34. The hyaluronate chains can be as long as 4 μm and can coordinate 100 or more proteoglycan units. Cartilage proteoglycan possesses a hyaluronic acid binding domain on the NH2-terminal portion of the polypeptide, which binds to hyaluronate with the assistance of a link protein.The proteoglycan - hyaluronate aggregates can have molecular weights of 2 million or more.
Figure 9.34 · Hyaluronate (see Figure 7.33) forms the backbone of proteoglycan structures, such as those found in cartilage. The proteoglycan subunits consist of a core protein containing numerous O-linked and N-linked glycosaminoglycans. In cartilage, these highly hydrated proteoglycan structures are enmeshed in a network of collagen fibers. Release (and subsequent reabsorption) of water by these structures during compression accounts for the shock-absorbing qualities of cartilaginous tissue.
The proteoglycan - hyaluronate aggregates are highly hydrated by virtue of strong interactions between water molecules and the polyanionic complex.
When cartilage is compressed (such as when joints absorb the impact of walking or running), water is briefly squeezed out of the cartilage tissue and then reabsorbed when the stress is diminished. This reversible hydration gives cartilage its flexible, shock-absorbing qualities and cushions the joints during physical activities that might otherwise injure the involved tissues.
3) 물(water)
- 관절 연골의 가장 풍부한 구성요소인 물은 관절 표면근처에 대부분 집중. 물은 연골의 역학적이고 생리 화학적인 반응에 큰 영향을 미치는 자유 움직임 양이온(Na, K, Ca+)을 포함.
- 관절연골의 액체성분은 연골세포와 주변의 영양이 풍부한 활액간의 가스, 영양분, 그리고 노폐물의 출입운동을 허용함으로써 이 무혈관성 조직의 건강에 필수적
- 연골에서는 작은 비율의 물만이 세포내에 존재하며 약 30%는 교원섬유와 강하게 연결. 물과의 사이에 돈난 산투압을 통해 상호작용함으로써 ECM의 구조적 구성과 그것의 부종특성을 조절하는 중요한 기능.