
효소
酵素 / Enzyme
촉매의 일종으로, 대부분 아미노산이 중합된 단백질이다. 상당수가 금속 이온과 결합해 있다.
효소는 생물 활동의 핵심으로, 모든 생명활동들엔 이러한 효소가 관여한다. 또 그런 효소는 유전자의 신호를 통해 작용한다.
한 생명체 안에 물질대사가 작동하지 못하면 생명 시스템이 유지될 수 없듯이, 효소도 마찬가지로, 이 수많은 물질대사에 관여하기 때문에 효소가 없을 경우에도 여러가지 이상 증세가 나타나 건강을 악화시킬 수 있다. 사실 우리가 알고 있는 대부분의 단백질이 효소라고 보면 된다.
효소가 필요한 이유는 생물체가 살기 위해 필요한 화학반응을 낮은 온도에서 빠르게 할 수 있게 하기 때문이다. 효소 없이 화학반응을 일으키기 위해서는 오랫동안 기다리거나 온도를 높이면 된다. 그런데 기다린다는 게 조금이 아니라, 어떤 반응은 효소가 없으면 몇 백억 년이 걸리는 경우도 있다. 또한 온도를 높이는 방식도 문제가 있는데, 몸에 불을 붙이면 그게 효소 없이 온도를 높여 유발된 화학반응이다. 이런 식의 화학반응은 에너지가 한꺼번에 나오기 때문에 중간에 손실되는 에너지가 많을 뿐 아니라 위험하다.
반면, 효소를 이용한 화학반응은 에너지가 단계적으로 조금씩 나오도록 조절하여 에너지 이용의 효율성뿐만 아니라 안전성까지 갖추고 있다. 이처럼 효소는 생체활동의 필수요소다. 생체촉매가 없으면 식사 한 끼가 소화되는 데 50년 이상 걸릴지도 모른다. 직관적인 예를 들자면, 당신이 암석을 분쇄하는 일을 해야한다고 치자. 이때 효소란 이를 부술 수 있는 약품이다. 만약 당신에게 이런 도구가 없다면 맨손으로 돌을 부수려다 손만 상하고, 돌이 자연적으로 풍화될 때까지의 영겁의 세월을 기다릴 수 밖에 없다!
이러한 생명체의 효소에 대한 의존성은 거의 모든 생물에서 볼 수 있는 보편적인 것이다. 일반적으로 흔히 볼 수 있는 동/식물은 말할 것도 없으며, 세균도 만들어낸다. 바이러스는 자체적으로는 효소를 만들 수 없고 숙주 세포의 리보솜 등을 이용하여 단백질을 만든다.(바이러스는 숙주에 대한 의존성 때문에 생물과 비생물의 경계에 있다.) 이렇게 만든 효소로 여러 활동을 하는 것이다. 결국 모든 생물 활동에 없어서는 안될 존재다.
효소의 연구는 1700년대 후반으로 거슬러 올라간다. 1785년 이탈리아의 가톨릭 성직자이자 생물학자, 동물학자였던 라차로 스팔라차니(Lazzaro Spallanzani, 1729 ~ 1799)는 새의 위액이 고기를 분해하는 현상을 관찰했다. 그리고 1825년, 독일의 과학자 테오도르 슈반(Theodor Schwann, 1810 ~ 1882)은 새의 위액이 산성 조건에서만 고기를 분해하며, 열을 가하면 그 능력을 잃는 것을 발견했다. 슈반은 이 성분을 펩신이라고 명명했으며, 분해 과정에서 펩신이 소모되지 않는 것으로부터 펩신이 촉매임을 밝혀냈다. 이후 술의 발효과정 또한 효모 안의 효소의 작용 때문임이 밝혀졌으며, 1897년 독일의 에두아르트 부흐너(Eduard Buchner, 1860 ~ 1917)와 한스 에른스트 아우구스트 부흐너 (Hans Ernst August Buchner, 1850 ~ 1902)형제가 효모 추출액도 알코올 발효를 일으킨다는 사실을 발견해 효소가 단백질임을 밝혀냈고, 1907년 노벨상을 수상한다.
많은 효소 연구는 효모를 기반으로 이루어졌다. 효소의 영문명인 엔자임(enzyme)부터가 접두사 en-에 효모를 뜻하는 -zyme이 결합된 형태. 효소라는 이름 자체도 효모에서 유래되었다. 참고로 이 효소라는 이름은 맥주의 나라 독일의 화학자이자 생리학자였던 빌헬름 프리드리히 퀴네(Wilhelm Friedrich Kühne, 1837 ~ 1900)가 처음 사용했다.
DNA - 효소 조절
DNA가 생체 활동을 조절하는 원리 중 하나가 효소 발현을 조절하는 것이다. 유전정보가 잘못되어 비정상적인 효소를 만들거나, 혹은 정상 효소를 만들더라도 그 양이 적절하지 않다면 생체활동에 문제가 생기게 된다. 유전병은 대체로 효소와 관련된 유전정보에 선천적으로 문제가 생긴 것이며, 방사선은 DNA 정보를 교란시켜 효소 정보에 오류가 생기게 유발한다.
일반적인 촉매에 비해 효과 하나는 작살이지만, 주성분이 단백질인지라 열에 약하다. 일반적으로 섭씨 40도만 돼도 버틸 수가 없다! 이외에도 pH 등의 영향을 크게 받는다. 하지만 일부 미생물은 90도가 넘는 고온과 산성환경에서도 활성을 유지하는 극한효소를 갖고 있어 생존하는 경우도 있다. 대표적으로 RNase가 있는데, 이 녀석은 끓였다가 식혀도 활성이 남아있다. 이런 극한효소들은 PCR 등 각종 산업과 연구에 많이 쓰이고 있다.
효소의 이름은 주로 그 기질의 이름과 효소가 일으키는 화학반응을 통해 결정하는데, 인산화(phosphorylation)시키는 효소는 kinase, 분해 효소는 ~ase 등을 붙여 부른다. 이걸 과거 교육과정에서는 아제로 표기했으나, 개정된 교육과정에서는 에이스로 바뀌었다. 일부 상용화된 소화제의 이름이 X아제인 것도 이 때문이다.
효소 구성
주효소
효소의 단백질로 이루어진 부분이며 단백질인 만큼 환경(온도, pH)에 영향을 많이 받는다.
보조인자
보조인자는 효소의 비단백질 부분으로 주효소에 비해 크기가 작으며, 온도와 pH의 영향을 덜 받는다. 보조인자는 금속 이온과 coenzyme(조효소)로 분류된다.이때 보조인자는 보결족이라고 부르며 단백질과 공유결합을 이루어 영구히 결합한다.
조효소
Co-enzyme, CoA
대부분이 유기물이며 비타민등으로 이루어져 있다. 효소 반응시 주효소에 일시적인 결합을 하며, 반응이 끝난 뒤에는 주효소로부터 분리되며 한 종류의 주효소가 여러 종류의 조효소와 결합 되어도 활성화가 유효하다.
메커니즘
효소엔 '활성 부위'라 불리는 특정한 부분을 가지고 있다. 이 활성 부위는 특정 화학적 반응이 일어나는 부분이며, 이 활성 부위의 구조와 화학적 특성이 효소의 특정 기능을 결정한다. 이때 활성 부위는 기질과 결합하여 '효소-기질 복합체'를 형성하는데, 이 과정에서 활성 부위의 구조가 기질과 상호작용하여 화학 반응을 진행할 수 있도록 유도한다.
그리하여 활성 부위에 의해 촉매되는 화학 반응이 일어남으로써, 효소는 기질을 적절한 방식으로 변형시켜 원하는 화학적 변화를 일으킨다.
화학 반응 후, 생성된 생성물은 효소에서 분리되는데, 이때 효소는 변하지 않고 재활용이 되는데, 다시 활성 부위를 노출시켜 새로운 기질과 결합할 수 있게 된다.
하지만 모든 단백질이 그렇듯, 메커니즘의 기본 근간은 DNA다. 이런 효소들도 결국 DNA의 명령과 신호를 통해 작동 여부가 결정된다.
효소 작용
효소의 작용은 아주 다양하고 많지만, 그 중 독특하고 대표적인 예로 인간의 손가락이 있다. 발생학적 관점에서 인간의 손은 중간역학, 배경, 파지발달, 손가락 분화 순으로 일어나는데, 간략하게 접근해서, 손의 원형이 형성 되고 손가락 형성을 지시할 작은 돌기 같은 게 형성이 된다.
이후 손가락이 형성되고 남은 갈퀴들을 제거하는 작업에 들어가는데, 이러한 작업을 리소좀이 담당한다. 리소좀은 세포내 섭취, 세포외 배출을 담당하기 때문이다. 그렇게 남은 갈퀴들을 제거하고 난 뒤 형성된 것이 바로 우리의 손가락이다.
효소 목록
거의 모든 효소는 명칭이 -ase로 끝나며(lipase, kinase 등), 이를 반영해 우리말 명칭도 “-아제”로 끝나도록 만들어졌다.
주의할 점은 그 직전 음절에 모음 ‘아’가 포함되어 있더라도 “제”가 아니라 “아제”로 표기한다는 것이다(예: 리파제 X, 리파아제 O).
이는 “제”(劑)가 “약물”(즉 agent, drug)이라는 의미의 단어이기 때문에, 혼동을 막기 위해 이렇게 정해졌다. 예를 들어 ‘설파타제’, ‘수크라제’ 등으로 표기할 경우 그런 약물이 있는 것으로 오인할 수 있으나 ‘설파타아제’, ‘수크라아제’로 표기할 경우 효소임을 쉽게 알 수 있다.
최근에는 대부분의 효소에 표준 우리말 명칭이 붙여졌기 때문에 ‘키나아제’, ‘트랜스퍼라아제’같은 음차 명칭보다 ‘활성 효소’, ‘전달 효소’ 등의 알기 쉬운 명칭을 사용할 수 있다.
뉴클레이스
디하이드록실레이스
레닌
루비스코
루시페레이스
라이소자임
라이페이스: 중성 지방을 모노글리세리드(글리세롤+지방산)과 지방산 2개로 쪼개는 효소.
말테이스
셀룰레이스
아데닐산고리화효소
아밀레이스(디아스타아제)
트립신
펩신
ATP 합성효소: 미토콘드리아 내부 그리고 엽록체 내부에서 ATP를 만드는 효소. 마치 전화기 같은 생김새를 하고 있다. 막 안쪽과 바깥쪽의 수소 이온 농도의 차이를 이용해, 수소 이온이 ATP synthase를 통과할 때의 에너지를 이용해 ADP에 인산기를 붙여서 ATP를 생성한다. 참고로 synthase와 synthetase가 있는데 둘 다 뭔가를 합성하는 효소지만 synthetase는 ATP를 소모한다.
Na-K ATPase: 세포막에 위치해 ATP에서 얻은 에너지를 이용해 농도기울기를 거슬러 Na 이온을 밖으로 내보내고, K 이온을 안쪽으로 들여보내는 효소이다.
DNA 중합 효소
RNA 중합 효소
DNA 연결 효소/라이게이스
나이트로지네이스: 콩과 식물 뿌리에 기생하는 뿌리혹박테리아가 공기 중의 질소를 사용 가능한 형태로 바꿀 때 사용하는 효소.
수크레이스: 설탕을 포도당과 과당으로 쪼개는 효소.
락테이스: 유당을 분해하는 효소. 대부분은 성인이 되면서 우유를 섭취하는 양이 줄어듦에 따라 점차 사라진다. 이게 없으면 우유에 있는 유당을 분해하지 못하기 때문에 설사를 하게 된다. 이를 유당불내증이라고 한다.
말테이스: 엿당을 두 개의 포도당으로 쪼개는 효소.
베타락타메이스: 페니실린을 개발살내는 효소로 유명하다.
세퍼레이스: 세포분열 과정에서 붙어 있는 두 자매 염색분체들을 분리시켜주는 효소다.
아스코비네이스: 비타민C를 분해하는 효소.
엑소뉴클리에이스
엔도뉴클리에이스
엘라스테이스
옥시데이스: 기질을 산화시키는 효소. 꼭 산소를 얻는것만이 산화가 아니라, 전자나 수소를 잃는 것도 산화이다. 반대 역할을 하는 효소는 위에 있는 리덕테이스.
유레이스: 요소를 가수분해해 이산화 탄소와 암모니아로 만드는 효소.
카탈레이스: 마찬가지로 산화-환원반응을 매개하는 효소.
키티네이스: 키틴을 분해하는 효소.
토포아이소머레이스: DNA를 복제할 때, 앞에서 나선을 풀어갈수록 뒤쪽에서는 더 꼬여서 '양성 초나선'이 생기게 되는데, 이때 이 나선을 풀어주는 효소. 과정은 별거 없고, DNA를 뚝 자른 다름 돌려서 꼬인 것을 풀고 다시 붙인다.
탄산 무수화 효소: 적혈구에 있으며, 이산화 탄소와 물을 반응시켜 탄산을 만드는 효소. 이 방식으로 혈액에서 이산화 탄소를 운반한다.
트랜스퍼레이스: 치환반응을 하는 효소. 치환반응이란 A-B + C → A-C + B 의 형태를 갖는 반응을 말한다.
티아미네이즈: 비타민B1을 분해하는 효소. 익히지 않은 고사리에 많아서 생 고사리 중독 증상 중 하나로 각기병이 나타난다.
프로티네이스: 단백질을 분해하는 효소이다. 단백질이라고 해서 영구적으로 사용할 수 있는 것은 아니고, 낡거나 제 할 일을 다 마친 단백질은 분해된 다음 재활용하게 된다. 혹은 만들어진 단백질에 뭔가 이상이 있을 때 그 단백질을 분해하기도 한다.
헬리케이스: DNA의 이중 나선을 풀어버리는 효소이다.
하이드로제네이스: 수소 분자의 가역적인 산화/환원을 촉매하는 효소. 혐기성 세균에게는 상당히 중요한 녀석이다.
효소 식품
효소 식품에서 말하는 효소는 실제 효소와는 뭔가 다른 의미로 변질된 것이다. 사실상 과학적 지식이 부족한 대중들에게 무언가 팔아먹기 위해서 그럴듯하게 포장한 식품들이 매우 많다. 게다가 발효식품들은 산성인데, 알칼리성이라고 사기를 친다. 알칼리성과 알칼리성 식품은 다르다.
효소 함유 식품은 효소의 기능을 통해 음식물이 흡수되기 용이한 형태로 전환시킴으로써 영양소의 흡수를 촉진시키는 작용을 한다. 또한 효소와 식이섬유는 장의 연동운동을 촉진하여 배변을 도움으로써 변비를 호전시킨다. 즉 효소가 직접 작용하는 것은 음식의 소화, 흡수, 배설을 도와주는 정도가 끝이다. 소화기 계통의 질병이 아닌 다른 것을 치료한다고 말한다면 이는 분명한 사이비 약팔이라고 보면 된다. 예를 들면 이런 것. 혈액 순환이 어쩌고 하는 거 보면 이건 헛소리가 맞다. 그리고 효소는 일반인의 몸에서 부족할 수가 없다. 만약 효소가 부족하다면 그 사람은 이미 정상이 아닐 가능성이 높다.
효소 제품이 식품의약품안전처의 '건강기능식품' 목록에 포함되었던 적이 있다. 2004년에서 2007년까지 당시 식약청에서 건강기능식품류의 효능을 재평가했다. 이 과정에서 효소, 로열젤리 등은 제조사들이 효능을 입증하지 못했으나, 이들 원료를 당장 빼버리면 기업 경영에 큰 타격이 갈 수 있다는 이유로 2009년 연말까지 입증 기간을 넉넉히 주었다.# 그리고 2009년 연말이 왔으나 입증에 실패하여 2010년부터 제외되었다.# 하지만 여전히 알다시피, 건강기능식품 관련 내용만 쏙 뺀 채로 광고에는 온갖 내용을 다 붙여 말하고 있다. 비슷한 이야기인 음이온 관련한 내용과 비슷한 편이다.
또 식약처에서는 효소 식품을 식품에 효소를 다량 함유하게 한 것으로 정의하고 있다. 그냥 효소를 통째로 갖다 파는 경우도 있는데, 이는 그냥 효소지, 효소 식품은 아니다. 효소를 팔든 효소 식품을 팔든 둘 다 효과가 없다. 하술하듯 설탕 절임(청)을 효소로 둔갑시켜서 파는 경우도 있다. 종편 등의 건강 프로에 나오는 '효소 식품'은 전부 다 사실 설탕 절임이다. 그런데 이젠 시중의 요리책(전문 요리사가 아닌 개인 요리연구가 아니면 블로거들의 책)까지 "효소발효액"을 청과 별도로 분류한다.하도 욕을 먹었는지 자막은 청으로 넣는 경우가 많다.
사람은 효소를 직접 먹는다고 건강해지지는 않는다. 물론 효소가 생체활동의 필수요소이긴 하지만, 그걸 먹는다고 많이 확보되는 게 아니기 때문이다. 효소 식품이라는 것은 결국 단백질 덩어리이고, 이걸 먹으면 결국 위, 창자에서 단백질의 펩타이드 구조가 갈기갈기 찢어져서 흡수된다. 즉, 효소를 먹으나 지나가던 벌레를 먹으나 그저 훌륭한 단백질 공급원인 것이다. 게다가 이런 논리를 극단적으로 가져가면 피가 부족한 사람은 피를 마시면 되고 피부 조직이 비정상인 사람은 다른 사람의 피부 조직을 먹으면 된다는 결론이 나온다. 말도 안 되는 논리인 셈.
간단한 요약.
효소를 만병통치약으로 믿는 사람들은 이렇게 생각한다.
효소는 우리 몸의 필수요소이다.
그러니까 효소를 많이 먹으면 몸에 좋겠지?
그러니까 배양해서 먹자!(…)
게다가 이름이 비슷하다는 이유로 효모까지 비슷한 취급을 받고 있다. 당장에 효모는 빵에도 있는데 효모배양액 막걸리 어쩌고 하는 것을 홈쇼핑 등지에서 버젓이 팔고 있다. 효모도 위에 들어가면 그냥 죽는다. 피부에 정착할 수는 있다. 사타구니가 까맣게 되는 현상의 원인
한편, 이러한 비판에 대하여 감기, 타박상, 염좌 등에 흔하게 처방되던 몇몇 소염효소제의 효능이나, 위에서 파괴되지 않고 소화관을 통해 체내로 들어와도 기능을 하는 단백질이 일부 있다는 점을 들어 효소식품의 효과가 있을 수 있다고 반박하기도 한다. 문제는 한국에서 흔하게 쓰인 소염효소제의 과학적 근거가 빈약하다는 것이다. 경구 투여시 소화관에서 얼마나 흡수되어 어떤 혈중 농도를 보이며, 그로 인한 실제 효과가 어느 정도 되는가에 대한 연구가 거의 없어서 임상재평가 중이다. 실제로 소염효소제는 해외에서 경구용으로는 이미 퇴출되었으며, 스트렙토키나아제를 사용해도 정맥 주사를 통해 투여한다.
비유하자면, 약이 병을 치료한다는 명제만을 가지고 집에 있는 약을 마구 꺼내 먹는 것과 비슷하다. 주사제인제 관장약인지 무슨 질병에 얼마나 쓰이는 약인지는 얼마나 써야하는지는 관심이 없고 그냥 몸에 넣는 것이라고 볼 수 있다
사기 행위
전형적인 허위광고, 유사과학 식품 중 하나. 인터넷 쇼핑에서 효소식품으로 검색하면 냅다 효소를 갖다 파는 사람도 있기는 하지만, 종편 등의 방송에서 효소라고 부르는 것들은 대부분 꿀 설탕에 과일이나 채소를 오랫동안 담가놨다가 먹는 것인데, 그건 그냥 매실청같은 과일청이다. 영어로 하면 시럽. 설탕에 절여졌기 때문에 효소로 인한 발효는 커녕, 당절임 특성상 영양학적으로도 만병통치약과는 거리가 있다. 과일이나 채소를 다량의 설탕에 담가두면 중, 고등학교 과학시간에 배우는 확산 현상으로 과실 내부의 성분이 외부로 이동하기 때문에 결과적으로 과일 향이 나면서 달달하고 걸쭉한 액체가 만들어진다. 그래서 실제로 매실 말고도 다른 각 과일, 채소 고유의 효능이나 성분이 확산 현상과 함께 빠져나오는 경우는 흔하다. 애초에 저 과정이 일종의 추출 과정이라고 볼 수 있기 때문에 과일이나 채소의 성분이 청에 많이 함유되는 것도 이상하지 않다.
과일과 설탕으로 만드는 것이니 당연히 당 덩어리다만, 이렇게 만들어서 먹으면 그냥 먹기엔 너무 신 매실, 유자, 모과 등을 달달하고 맛있게 먹을 수 있다. 물론 종편에서 선전하는 만병통치약은 아니지만 매실청은 잘 알려진 것처럼 탈 났을 때 먹으면 좋으며, 음식에 설탕 대신 조미료로 쓰면 은은한 과일향이 더해지면서 색다른 요리를 만들 수도 있다. 시원하게 보관해 놨다가 물에 타 마시면 여름철 음료수로도 좋다.
다만 문제라면, 저걸 효소에다 밥을 준다고 표현하면서 대놓고 설탕치는 약팔이들도 많다.
당 섭취 측면에서 보면 절대 건강에 좋은 음식이 아니다. 매실청의 경우(당연히 이걸 매실효소라고 부르는 경우도 많다.) 집에서 만든 매실청 100g 당 당류 함량은 평균 49.6g, 시중에 판매하는 매실청 100g 당 당류 함량은 평균 57.2g 정도 된다. 물을 1대 4 비율로 희석해 매실음료(200ml)를 만든다고 가정하면 이 안에 들어가는 당류는 20~23g 수준이다. 두 번 정도 먹으면 WHO권장 당 섭취량을 가볍게 채울 수 있다. # 콜라의 당분 함량은 100㎖당 10.8g정도 되니, 콜라를 들이키는거나 매실청을 먹는거나 둘 다 비슷한 수준의 당분을 섭취하게 되는 것이다. 효소식품을 몸에 좋다고 믿는 사람들의 경우 콜라는 건강에 나쁘지만 효소는 몸에 좋다고 생각하는 경우가 대다수인데, 건강에 좋다는 이유로 당침출액을 정기적으로 복용하게 되면 탄산음료를 입에 달고 사는 수준으로 당분 섭취량이 많아져 인슐린 저항성이 증가할 위험이 있다는 것을 인지하여야 한다. 당뇨를 가지고 있는 사람이 효소가 몸에 좋다고 먹었다가 혈당조절에 실패한 사례들이 있다.
사실 이런 식품을 효소라고 부르는 용법은 일본에서 들어온 것인데, 정확히 말하면 효소주스(酵素ジュース)라고 부르며 일본에서도 유사과학이라고 싫어하는 사람들 역시 많다.
한창 유행했었을 때, 1학년 신입생들을 대상으로 대학교 생물학, 미생물학, 식품화학 계열 교수들이 효소식품의 허구성을 무진장 씹어댔다.
효소 잠재력 이론
인간이 태어나면서 평생 쓸 수 있는 소화 효소의 양이 정해져 있다는 유사과학##. 효소 총량의 법칙이라고도 불린다.
효소 잠재력 이론(Enzyme potential theory)은 에드워드 하웰(Edward Howell, 1898~1988)이 주장하였다. 에드워드 하웰은 자격이 있는 의사나 영양사가 아니었으나 1932년 국립 효소 회사를 설립하였고 '효소 요법'으로 많은 환자를 치료했다고 주장한다. 하웰의 주장은 다음과 같다.
날 음식을 많이 먹어야 한다. 날 음식의 효소는 인간의 소화 시스템으로 들어가서 음식을 소화하는 데 도움이 된다.
조리 과정에서 이러한 식품 효소가 파괴되고 인체는 자체 소화 효소를 더 많이 생산하도록 한다.
인체는 소화 효소를 제조하기 위한 '효소 잠재력'이 있으며 평생동안 생산할 수 있는 효소의 양이 정해져 있다.
날 음식의 효소에는 신비한 '생명력(life force)'이 있다.
효소에 대한 그의 주장은 과학적 근거가 없으며 신빙성이 없다. 음식에도 효소가 있는것은 사실이나 조리 과정이 없더라도 경구 섭취 과정에서 대부분이 파괴된다. 게다가 소화의 90%는 췌장에 의해 소장에서 일어나므로 날 음식을 섭취해야 한다는 주장은 틀린 것이다. 이와 연계되어 나오는 주장이 인간의 몸이 평생동안 생산하는 효소의 양, 특히 췌장의 기능에 제한이 있다는 것인데 이 또한 개인적인 주장일 뿐 근거가 없다. 실제로 인간은 평생 동안 새로운 효소를 생산해 내며 나이가 듦에 따라 생산량이 줄어들 수는 있으나 이는 전형적인 노화의 특징이다.
효소
효소(酵素, 영어: enzyme)는 기질과 결합해서 효소-기질 복합체를 형성하여 화학 반응의 활성화 에너지를 낮춤으로써 물질대사의 속도를 증가시키는 생체 촉매이다. 그리고 경우에 따라 속도를 조절하는 생체 보호기능을 수행하기도 한다. 효소는 기질을 생성물로 알려진 다른 분자로 전환시킨다. 세포의 거의 모든 대사 과정은 생명을 유지할 수 있을 만큼의 빠른 속도로 일어나야 하기 때문에 효소 촉매작용을 필요로 한다. 대사 경로는 효소에 의존하여 개별 단계들을 촉매한다. 효소에 대해 연구하는 학문을 효소학이라고 하며, 최근에 유사효소(pseudoenzyme) 분석의 새로운 분야가 성장하여 진화 과정에서 일부 효소가 생물학적 촉매 능력을 상실했다는 것을 알게 되었으며, 이는 종종 유사효소의 아미노산 서열과 특이한 유사촉매(pseudocatalytic) 특성에 기인한다.
효소는 5,000가지 이상의 생화학 반응 유형들을 촉매하는 것으로 알려져 있다. 대부분의 효소들은 단백질이지만, 일부 효소들은 촉매 기능을 가지고 있는 RNA 분자이다. 촉매 기능을 가지고 있는 RNA를 리보자임이라고 한다. 효소의 특이성은 독특한 3차원 구조에서 비롯된다.
다른 촉매들과 마찬가지로, 효소는 화학 반응의 활성화 에너지를 낮춤으로써 반응 속도를 증가시킨다. 어떤 효소들은 기질을 생성물로 전환시키는 것을 수백만 배 더 빨리 일어나게 할 수 있다. 극단적인 예로는 오로티딘 일인산 탈카복실화효소가 있는데, 이 효소는 수백만 년이 걸릴 수 있는 반응을 밀리세컨드 단위로 일어나게 한다. 화학적으로 효소는 다른 촉매들과 같아서 화학 반응에서 소모되지 않으며 반응의 평형을 변화시키지도 않는다. 효소는 훨씬 더 특이적이라는 점에서 대부분의 다른 촉매들과 다르다. 효소의 활성은 다른 분자에 의해 영향을 받을 수 있다. 저해제는 효소의 활성을 감소시키는 분자인 반면, 활성화제는 효소의 활성을 증가시키는 분자이다. 많은 약과 독은 효소 저해제이다. 효소의 활성은 최적 온도와 pH 범위 밖에서 현저하게 감소하며, 많은 효소들은 과도한 열에 노출되면 영구적으로 변성되어 구조와 촉매 특성을 상실하게 된다.
예를 들어 어떤 효소들은 항생제의 합성에 상업적으로 사용된다. 일부 가정용 제품들은 화학 반응의 속도를 높이기 위해 효소를 사용한다. 생물학적 세탁 세제에 들어 있는 효소는 옷에 묻은 단백질, 녹말, 지방의 얼룩을 분해하고, 고기 연화제에 들어 있는 효소는 단백질들을 더 작은 분자들로 분해하여 고기를 씹기 쉽게 만든다.
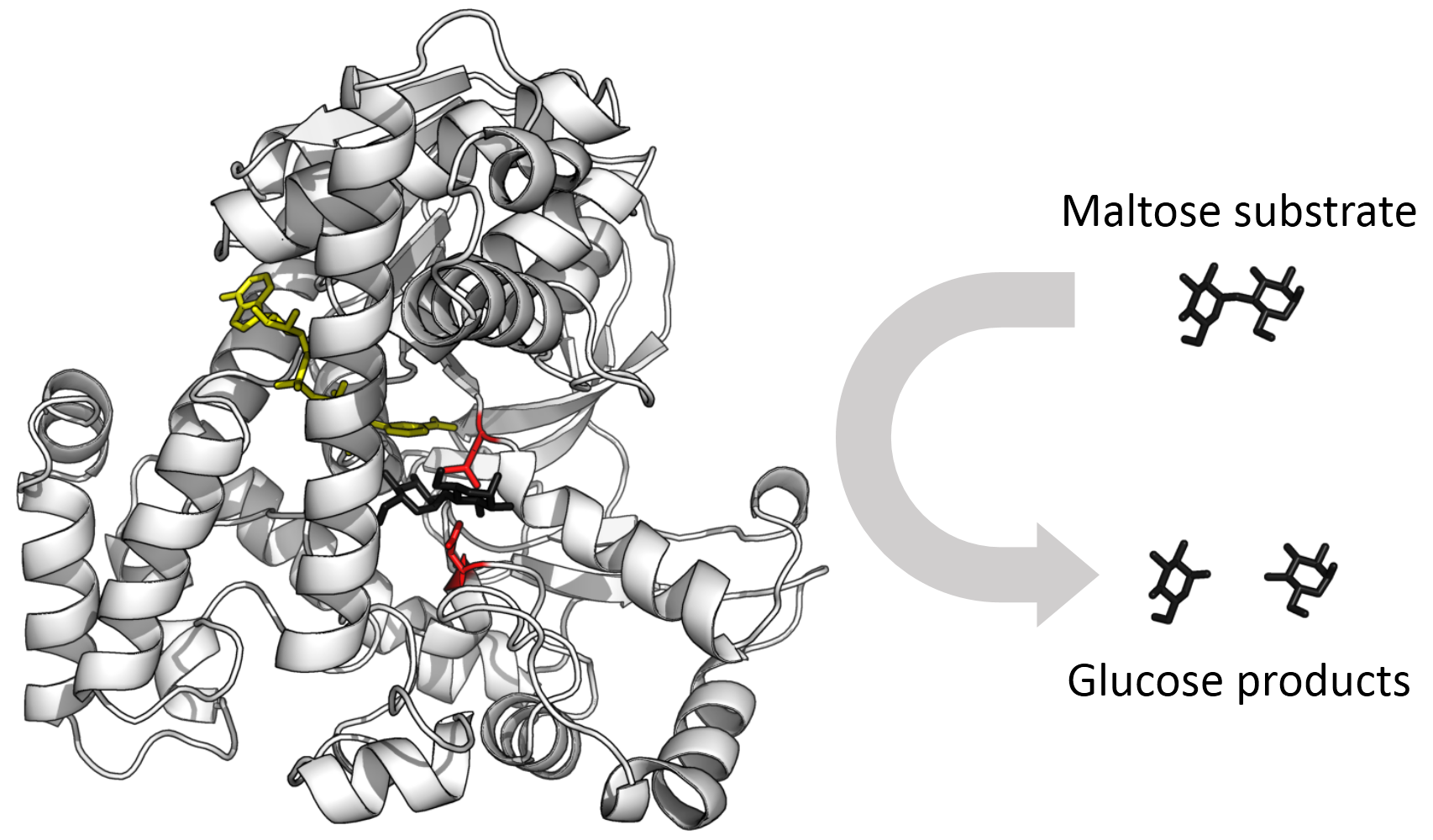
⑴ 물질대사 : 신체에서 일어나는 모든 화학반응
① 깁스 자유에너지
어떤 물질계가 주위에 대해 가역적으로 유효하게 사용할 수 있는 에너지를 총칭하며, 내부에너지 U의 르장드르 변환으로부터 얻어진다. 쉽게 말하자면, 가지고 있는 에너지 중 실제로 일로 변환될 수 있는 에너지라고 할 수 있다.
여기서 '가역적'은 화학 반응에서 사용하는 가역성과는 조금 다른 개념으로, 쉽게 설명하자면 미소량의 조건 변화만으로도 역반응이 일어날 수 있는 상태를 말한다. 이런 상태는 이론적으로만 존재하며 현실에서는 실현이 불가능하다.
: ΔH - TΔS < 0이면 반응은 자발적
② 생물학에서 ΔH ≒ ΔG로 간주
○ 발열반응(exergonic reaction) : ΔH < 0, 이화작용(catabolism)과 관련
○ 흡열반응(endergonic reaction) : ΔH > 0, 동화작용(anabolism)과 관련
③ 반응이 자발적이라도 활성화에너지(문턱 에너지)가 너무 높으면 반응속도가 느릴 수 있음
④ 활성화에너지
○ 정의 : 반응분자들이 화학반응을 일으키기 위해 필요한 최소한의 에너지
○ 활성화에너지가 낮아지면 반응할 수 있는 분자 수가 증가하여 반응속도 증가
○ 촉매(catalyst) : 반응물인 기질과 결합하여 활성화에너지를 낮춰 반응속도를 증가
○ 효소(enzyme) : 생체 촉매
⑵ 특징
① 특징 1. 기질특이성 : 효소는 자신의 활성부위와 입체구조가 맞는 특정 기질에만 작용하여 반응 촉매
○ 자물쇠·열쇠 모델(lock and key model) : 효소의 활성부위가 기질과 완전히 일치한다는 모델
○ 유도적합 모델(induced fit model) : 효소가 기질과 결합 시 기질에 맞는 완전히 상보적인 구조로 변한다는 모델
○ 1st. 기질의 모양은 효소 활성 부위와 대략적으로 유사
○ 2nd. 기질이 활성부위에 결합 시 효소는 모양이 변하고 화학결합이 압박
○ 3rd. 모양의 변화는 기질을 분해하고 단위체를 방출
○ 유사효소(isozyme, enzyme multiplicity)
○ 같은 생화학 반응에 관여하는 서로 다른 효소
○ 작용하는 세포에 따라 다른 특징을 가짐 (예 : hexokinase, LDH(lactose dehydrogenase))
○ 각각 다른 최종산물에 의해 피드백 조절을 받음, 그 결과 최종산물 종류에 따라 다른 효소가 작용
② 특징 2. 재사용 : 반응 전후 효소의 양은 동일
④ 특징 3. 효소는 반응속도에만 영향을 미칠 뿐 반응열의 크기에 영향을 주지 않음
⑤ 특징 4. 공통조상에서 유래 : 다른 생물들이 같은 효소를 이용하는 경우 ↑
⑶ 효소의 구성
① 효소의 분류 : RNA 효소(ribozyme이라고 함)와 단백질 효소로 구분, 일반적으로 단백질 효소를 지칭
② 활성부위(active site) : 기질(substrate)과 결합하는 부위
③ 전효소(holoenzyme) : 완전한 활성을 나타내는 효소
④ 주효소(apoenzyme) : 전효소 중 단백질 부분
⑤ 보조인자 : 전효소 중 비단백질 부분. 활성부위에 붙어 활성부위를 완성시킴
○ 조효소(coenzyme) : 효소의 활성을 위해 필요한 유기물 분자
○ 예 : 비타민 유도체, NAD+, FAD
○ 무기이온 : Fe2+, Cu2+, Mg2+, Zn2+ 등의 금속 원소
○ 보결족(prosthetic group) : 보조인자 중 효소와 매우 강하게 결합되어 있어 영구적인 결합을 하는 것
○ 포르피린 고리는 보결족을 형성하는 대표적인 화학 구조로 다음과 같은 예가 있음
○ 예 1. 헤모글로빈 헴 그룹 : 포르피린 고리에 Fe2+이 포함된 유기화합물
○ 예 2. 미오글로빈
○ 예 3. 엽록소
○ 예 4. 시토크롬 P450(cytochrome P450, CYP)
⑥ 아밀레이스, 펩신, 라이페이스 등의 가수분해 효소는 대부분 단백질로만 구성돼 있음
⑶ 효소의 촉매 기작
① 산-염기 촉매(acid-base catalysis)
② 공유 촉매(covalent catalysis)
③ 금속 이온 촉매(metal ion catalysis)
④ 정전기적 촉매(electrostatic catalysis)
⑤ 근접과 배향효과(proximity and orientation effects)
⑥ 전이상태 복합체의 차별적 결합(preferential binding of the transition state complex)
⑷ 효소의 작용에 영향을 미치는 요인
① 요인 1. 기질 농도
○ 미카엘리스-멘텐 방정식과 관련
○ 기질의 농도가 증가함에 따라 초기 반응속도가 증가하다가 일정 수준에 이르면 일정해짐
○ 모든 효소가 기질로 포화되면 기질의 농도가 증가해도 초기 반응속도는 더이상 증가하지 않음
② 요인 2. 온도
○ 온도가 높아질수록 활성화에너지 이상의 운동에너지를 가지는 분자수가 증가하여 반응속도 증가
○ 효소가 관여하는 화학반응은 효소가 최적 입체구조를 갖는 최적 온도에서 가장 반응속도가 빠름
○ 최적 온도 이상이 되면 단백질이 열에 의해 비가역적으로 변성되어 온도를 낮추어도 회복되지 않음
③ 요인 3. pH
○ 효소가 관여하는 화학반응은 최적 pH에서 가장 반응속도가 빠름
○ 효소를 구성하는 아미노산 잔기의 하전 상태는 수소 이온의 농도 변화에 따라 달라지므로 최적 pH를 벗어나면 단백질의 알짜 전하를 변화시켜서 정전기적 반발을 일으키고 효소의 입체구조를 변화시킴
○ 예 : 펩신 1.5, 카탈레이스 : 7.6, 트립신 : 7.7, 퓨마레이스 : 7.8, 라이보뉴클리에이스 : 7.8, 아르지네이스 : 9.7
④ 효소의 반응속도 지수
○ 효소 1 유닛(unit) : 1분 동안에 1 μmol의 생성물을 생성할 수 있는 효소의 활성
○ 효소 활성(activity) = 효소 유닛(unit) / 효소의 양(ml)
⑸ 효소의 분류 : IUPAC에 의해 규정. enzyme commission number라고도 함
① EC1 : 산화환원효소(oxidoreductase)
○ 산화환원을 매개하는 효소로 수소, 산소, 전자의 전달 기작이 발생
○ 종류 1. "반응물 + dehydrogenase" (예 : lactose dehydrogenase, alcohol dehydrogenase)
② EC2 : 전이효소(transferase)
○ 메틸기, 아실기, 아미노기 등의 작용기를 다른 물질로 전달
○ 종류 1. "trans + 반응물 + -ase" (예 : 아미노기전이효소(transaminase), 아세틸기전이효소(transacetylase))
○ 종류 2. "반응물 + -kinase" (예 : 육탄당인산화효소(hexokinase))
③ EC3 : 가수분해효소(hydrolase)
○ 가수분해(hydrolysis) 및 탈수축합반응(condensation)에 참여
○ 종류 1. "반응물 + -ase" (예 : protease, peptidase)
④ EC4 : 분해효소(lyase)
○ 기질의 C-C, C-O, C-N, C-S 결합 등을 절단하여 원자단의 첨가나 제거를 촉매
○ 부가반응은 2기질 반응, 탈리반응은 1기질 반응
○ EC4.4 : C-N 분해효소
○ EC4.5 : C-할로겐 분해효소
○ EC4.6 : P-O 분해효소
○ 종류 1. "반응물 + decarboxylase" (예 : pyruvate decarboxylase)
⑤ EC5 : 이성질화효소(isomerase)
○ 물질의 구조를 재배열하는 효소
○ 종류 1. "반응물 + isomerase" (예 : phosphoglucose isomerase)
○ 종류 2. "반응물 + mutase"
⑥ EC6 : 연결효소(ligase)
○ ATP를 사용하여 두 물질 간에 새로운 결합을 형성
○ 종류 1. "반응물 + ligase" (예 : DNA ligase)
⑹ 미카엘리스-멘텐 방정식
⑺ 저해제 : 생체 내에서도 되먹임 억제를 위해 효소 저해 기작이 있으나 저해제와 달리 반응이 가역적
① 비가역적 저해(irreversible inhibition)
○ 예 1. 페니실린(penicillin)
○ 세균의 세포벽(펩티도글리칸) 합성효소(transpeptidase) 저해제
○ 활성부위와 반영구적인 공유결합을 하기 때문에 강력함
○ 예 2. 사린 가스
○ 아세틸콜린 에스터라제의 정상 활성 : 아세틸콜린은 콜린과 아세트산으로 분해. 아세트산은 아세트산 이온과 H+로 해리
○ 1st. 사린 가스가 아세틸콜린 에스터라제의 활성부위에 비가역적으로 결합
○ 2nd. 아세틸콜린↑
○ 3rd. 근육경련, 동공축소, 정신착란, 호흡곤란
② 가역적 저해(reversible inhibition) : 경쟁적 저해, 반경쟁적 저해, 비경쟁적 저해로 구분
○ (주석) 경쟁적, 반경쟁적, 비경쟁적 저해를 말할 때 가역적, 비가역적을 굳이 따지지 않는 경우도 많음
③ 경쟁적 저해(competitive inhibition)
○ 기질과 같은 활성부위를 놓고 효소반응에 경쟁적으로 참가하여 효소반응을 저해
○ 미카엘리스-멘텐 방정식 (참고 ⑹)
○ 활성효소의 형태를 변형시키지 않음
○ 예시
○ 이부프로펜(Ibuprofen) : 프로스타글란딘 생산 억제
○ 말론산-숙신산탈수소효소 : 숙신산 탈수소 효소는 숙신산을 산화시키는데, 숙신산의 경쟁적 저해제인 말론산이 숙신산 탈수소 효소의 활성 부위에 결합하면 숙신산의 산화 반응이 저해됨
○ 스타틴-HMG-CoA reductase
○ 글리벡-Bcl-abr의 Ras 인산화작용
○ HIV 단백질 분해효소
○ 기타 항우울제, 항생제, 살충제
④ 반경쟁적 저해(무경쟁적 저해, uncompetitive inhibition)
○ 효소-기질 복합체에 저해제가 결합하여 효소반응을 저해
○ 미카엘리스-멘텐 방정식
⑤ 비경쟁적 저해(noncompetitive inhibiton)
○ 활성부위가 아닌 다른 자리(allosteric site)와 결합하여 효소반응에 비경쟁적으로 참가하여 효소반응을 저해
○ 미카엘리스-멘텐 방정식
○ 활성효소의 형태를 변화시킴
⑻ 협동성
① 억제자 혹은 활성자 대신 기질 자체가 효소 활성을 조절하는 것
② 양성적 협동성 : 다기질 효소에서 이미 결합된 기질이 다른 기질의 결합을 도와주는 것
③ 음성적 협동성 : 있긴 있으나 극히 드묾
④ 반응식 : 협동성이 있으면 ES1이 생긴 이후 순식간에 ESn이 생기므로 ES1, ···, ESn-1을 고려할 필요가 없음
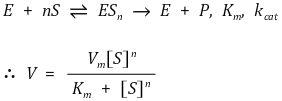
⑤ 예 : 헤모글로빈의 산소포화도
○ 헤모글로빈은 4개의 소단위로 구성되어 있으며, 각 소단위는 하나의 산소결합 부위를 가짐
○ 헤모글로빈은 sigmoid 곡선 개형의 산소포화도 곡선을 나타냄
○ 산소 한 분자가 하나의 결합 부위에 붙으면 나머지 결합 부위들에서 산소 친화력 정도가 증가
○ 하지만 산소가 없는 지역에서 산소 분자가 하나 떨어지기 시작하면 나머지도 떨어짐
○ 미오글로빈은 하나의 서브유닛으로 되어 있어 협동성이 없으므로 hyperbolic 곡선 개형의 산소포화도 곡선을 나타냄
⑼ 효소 활성 조절 메커니즘
① 억제자에 의한 조절
② 협동성에 의한 조절
③ 알로스테릭 조절 (다른 자리 입체성 조절, allosteric control)
○ 조절 분자체 : 단백질에 붙어 단백질의 입체 구조를 바꾸어 단백질의 기능이 달라지도록 하는 작은 분자
○ 조절 분자체는 기질이 아님
○ 조절 분자체에는 억제자 혹은 활성자가 존재함
○ 다른 자리 입체성 조절 (알로스테릭 조절)
○ 효소에 활성자 혹은 억제자가 기질 결합 부위가 아닌 다른 조절 부위에 붙어 기질의 반응을 활성 혹은 억제시키는 것을 말함
○ 이때 다른 조절 부위를 알로스테릭 부위라고 함
○ 알로스테릭 조절은 비가역적 반응을 관여하는 효소에서 일어남
○ 예시 : ATP는 세포 호흡에 관여하는 효소에 억제자로, ADP는 활성자로 작용하여 세포호흡을 조절함
○ PFK-1은 F-6-ⓟ을 F-1,6-bisphosphate로 생성하는 데 관여하는 효소임
○ ATP는 PFK-1의 기질이기 때문에 PFK-1은 ATP의 알로스테릭 조절을 받음
○ ATP의 양을 x축, PFK-1의 활성을 y축으로 하는 그래프는 종 모양의 그래프(bell-shaped graph)를 보임
○ 응용 1. 저해제 (억제제)
○ 일반적인 알로스테릭 조절은 저해제처럼 반응을 완전히 차단하지는 않음
○ 효소에 억제자가 붙어 다른 자리 입체성 조절을 발현하는 것을 비경쟁적 억제라고 함
○ 경쟁적 억제제는 다른 자리가 아니라 기질이 달라붙는 그 활성부위에 붙는 것이므로 알로스테릭 조절이 아님
○ 응용 2. 되먹임 억제(feedback inhibition)
○ 경로의 초기에 작용한 효소에 최종 생성물이 억제적으로 결합함으로써 물질대사 경로가 조절되는 기작을 꺼지게 하는 것
④ 인산기를 통한 조절
⑤ 조절단백질
○ 예 : Ca2+-칼모듈린의 NO synthase 조절
⑽ 효소 고정화(enzyme immobilization) : 효소를 특정 위치에 고정시키는 것
① 포획법(entrapment, encapsulation) : 물리적인 효소 고정화 방법으로 가장 널리 사용
○ porous hollow fiber
○ spun fiber
○ gel matrix
○ micro-capsule
② 결합법 : 화학적인 효소 고정화 방법, 담체 표면의 작용기와 효소의 작용기간 화학적 힘으로 고정시키는 방법
③ effective factor = reaction rate with diffusion limitation / reaction rate without diffusion limitation
○ 효소를 고정화함으로써 반응률이 얼마나 좋아졌는지를 나타냄
○ 효소의 농도 ↑ → effective factor ↓ (고정 여부에 관계없이 농도가 높으므로 반응이 잘 일어난다는 의미)
⑾ 효소 정량법
① UV spectrometer : Phe, Trp, Tyr의 페닐기의 흡광도인 280 ㎚를 대표적으로 사용함
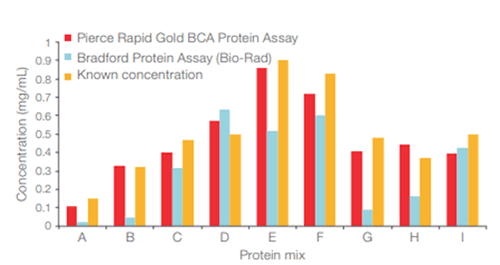
② Bradford method : Coomassie Blue G 염색약이 단백질과 결합함으로써 생기는 파장의 변화 측정
○ 장점 : 정량 시간이 매우 빠르고 간단함
○ 단점 : 단백질마다 염색약과 결합하는 정도가 다름
○ 응용 1. Pierce 660 nm protein assay
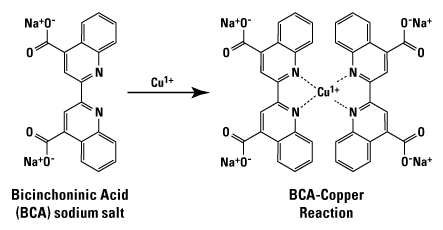
③ BCA method(bicinchoninic acid method) : 아미노산 내 아마이드 결합에 의한 구리 이온의 환원을 토대로 측정
○ 현재 가장 자주 사용되고 있는 단백질 정량 프로토콜
○ 장점 : 단백질 간의 차이가 근소. sensitivity가 우수함
○ 단점 : 준비시약이 많음. 절차가 복잡함. 다른 환원제, 구리 킬레이터, 고농도의 버퍼에 의해 간섭을 받을 수 있음
○ 환원제의 예 : DTT, β-ME
○ 구리 킬레이터의 예 : EDTA, EGTA
○ 단계 1. Cu2+ → Cu+
○ 주로 시스테인(cysteine), 시스틴(cystine), 티로신(tyrosine), tryptophan에 의해 환원됨
○ Bradford method와 달리 peptide backbone도 환원반응에 관여하기 때문에 단백질 간 차이가 적어짐
○ 단계 2. Cu+와 착물을 reagent가 착물을 형성하여 색깔이 변함
○ apple green의 Cu2+에서 보라색의 Cu+-BCA complex가 형성됨
○ 뷰렛 반응(biuret reaction), Lowry method, Peterson method, 뷰렛 반응 등 변형된 프로토콜이 있음
④ fluorescent protein assay
○ Thermo Scientific Quanti-iT, Qubit and NanoOrange protein assay
○ NanoOrange Protein Quantitation Kit
○ CBQCA Protein Quantitation Kit
○ EZQ Protein Quantitation Kit
○ Fluorometer
○ Invitrogen Qubit Fluorometer
⑿ 효소의 예
① 예 1. 포도당 운반체(GLUT, glucose transporter) : 세포막에서 포도당 운반
○ 특징 : 양방향성. D형 포도당만 포도당 운반체로 운반될 수 있음. 세포막을 12번 통과
○ GLUT1 : 모든 세포에 존재. 암세포에 많음. Km = 1 mM
○ GLUT2 : 간, 이자 β세포, 소장에 존재. Km = 10 ~ 20 mM. 애초에 포도당이 많으므로 감도 낮음
○ GLUT3 : 뇌에 존재. 면역세포에 많음. Km = 1 mM . 뇌는 에너지 수요가 높으므로 감도 높음
○ GLUT4 : 근육, 지방에 존재. Km = 5 ~ 10 mM. 인슐린에 의해 조건부 발현
○ GLUT5 : 과당 운반체. 소장에 존재
○ GLUT와 인슐린 분비 메커니즘
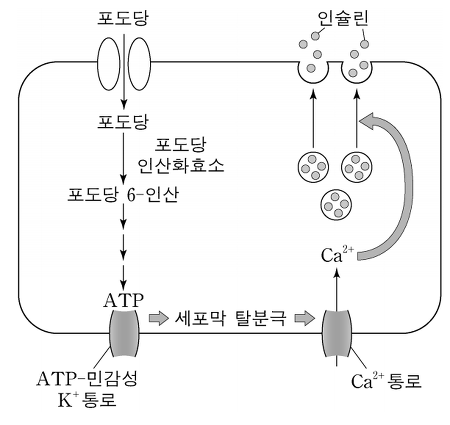
○ 1st. 혈중 포도당 농도 증가
○ 2nd. 포도당은 GLUT2를 통해 췌장 베타세포 내로 들어감
○ 3rd. 포도당은 해당과정과 TCA cycle을 통해 다량의 ATP를 생성. 포도당인산화효소는 glucose sensor로 작용
○ 4th. 생성된 ATP는 ATP-민감성 K+ 통로를 차단하여 세포 내부의 양이온 함량을 증가시킴
○ 5th. 세포막이 탈분극되면서 Ca2+ 통로가 열림
○ 6th. Ca2+는 베타세포 내로 들어온 뒤 인슐린 소낭의 방출을 촉진하여 혈류 내 인슐린 농도를 높임
○ 7th. 인슐린은 근육세포에 들어간 뒤 GLUT4 소낭의 세포막 이동을 촉진시킴
○ 8th. GLUT4 소낭 내 GLUT4는 근육세포 세포막에 발현됨
○ 9th. GLUT4가 GLUT2보다 감도가 높아 포도당이 근육과 지방으로 집중 → 혈당량 감소
② 예 2. 설탕 가수분해효소
○ 설탕을 포도당과 과당으로 분해하는 가수분해효소
○ 작용부위만 갖는 단량체 구조로 다른 자리 입체성 구조를 갖지 않음
③ 예 3. 젖산탈수소효소(LDH, lactose dehydrogenase)
○ H (heat form) 또는 M (muscle form) 단위체 4개로 구성
○ 총 5 종류 : H4, H3M, H2M2, HM3, M4
○ H의 등전점은 5.7, M의 등전점은 8.4임
○ 근육 : muscle form LDH에 의해 피루브산 → 젖산 (∵ 근육은 젖산발효가 일어나므로)
○ 간 : muscle form LDH에 의해 젖산 → 피루브산 (∵ 간은 포도당 신생합성이 일어나므로)
○ 심장 : heart form LDH에 의해 젖산 → 피루브산 (∵ 심장은 젖산을 에너지원으로 이용해야 하므로)
④ 예 4. 육탄당인산화효소(hexokinase)
○ hexokinase Ⅰ : 근육에 존재, 포도당에 대한 기질 친화성이 매우 높음
○ hexokinase Ⅳ : 간에 존재, 포도당에 대한 기질 친화성이 낮음
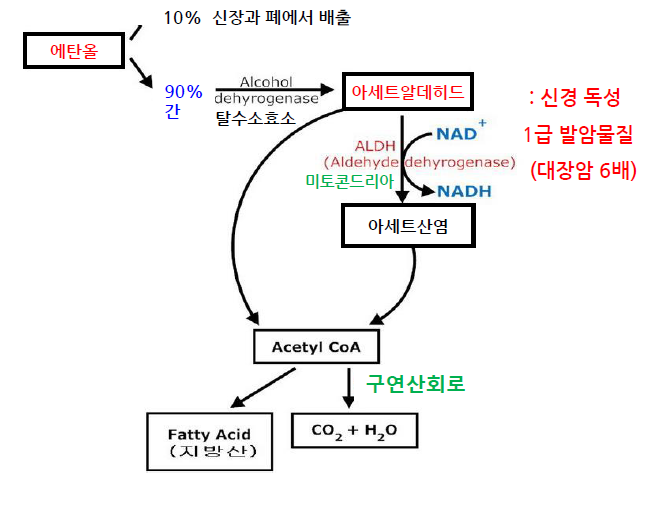
⑤ 예 5. 에탄올 분해
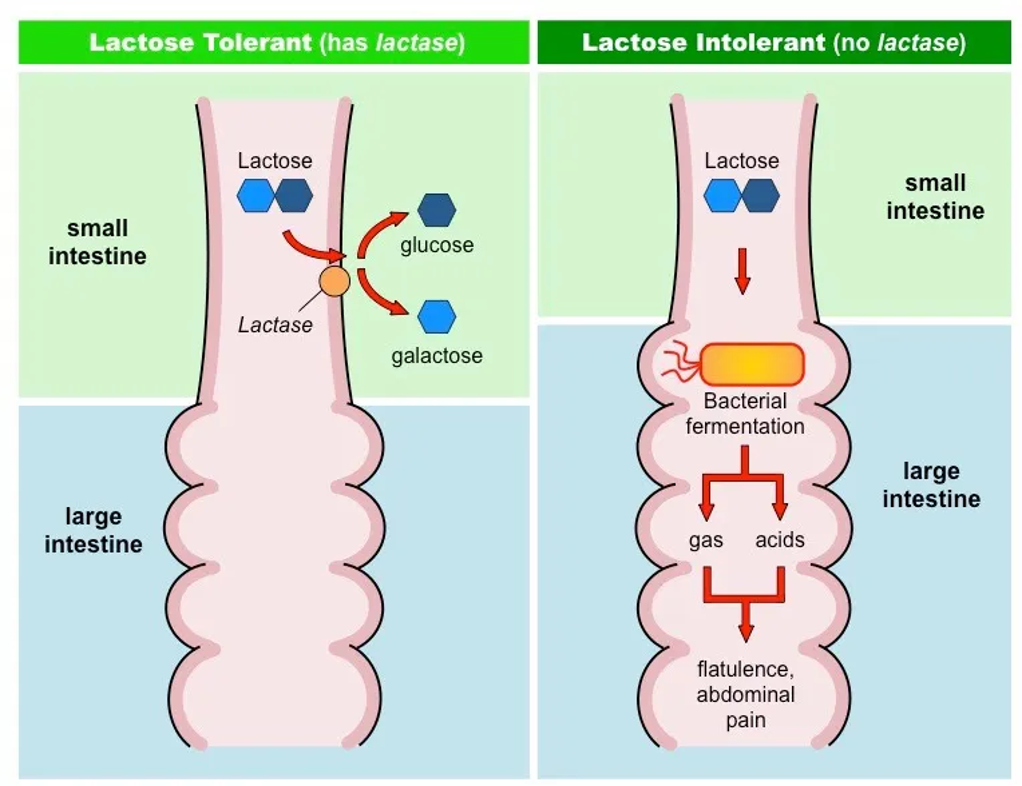
⑥ 예 6. 젖당 비내성(유당불내증, lactose intolerance)
○ 유아에게는 젖당 분해효소가 잘 분비되지만 성인이 되면서 결핍
○ 유럽 국가에서는 젖당 비내성이 잘 나타나지 않음
○ 과정 : 소장에서 락타아제 결핍 → 젖당 소화 불가 → 세균이 젖산 분해 → 가스 및 설사 원인
Enzymes
The human body is composed of different types of cells, tissues and other complex organs. For efficient functioning, our body releases some chemicals to accelerate biological processes such as respiration, digestion, excretion and a few other metabolic activities to sustain a healthy life. Hence, enzymes are pivotal in all living entities which govern all the biological processes.
Table of Contents
Let us understand what are enzymes, types, their structure, mechanism and various factors that affect its activity.
What Are Enzymes?
“Enzymes can be defined as biological polymers that catalyze biochemical reactions.”
The majority of enzymes are proteins with catalytic capabilities crucial to perform different processes. Metabolic processes and other chemical reactions in the cell are carried out by a set of enzymes that are necessary to sustain life.
The initial stage of metabolic process depends upon the enzymes, which react with a molecule and is called the substrate. Enzymes convert the substrates into other distinct molecules, which are known as products.
The regulation of enzymes has been a key element in clinical diagnosis because of their role in maintaining life processes. The macromolecular components of all enzymes consist of protein, except in the class of RNA catalysts called ribozymes. The word ribozyme is derived from the ribonucleic acid enzyme. Many ribozymes are molecules of ribonucleic acid, which catalyze reactions in one of their own bonds or among other RNAs.
Enzymes are found in all tissues and fluids of the body. Catalysis of all reactions taking place in metabolic pathways is carried out by intracellular enzymes. The enzymes in the plasma membrane govern the catalysis in the cells as a response to cellular signals and enzymes in the circulatory system regulate the clotting of blood. Most of the critical life processes are established on the functions of enzymes.
Enzyme Structure
Enzymes are a linear chain of amino acids, which give rise to a three-dimensional structure. The sequence of amino acids specifies the structure, which in turn identifies the catalytic activity of the enzyme. Upon heating, the enzyme’s structure denatures, resulting in a loss of enzyme activity, which typically is associated with temperature.
Compared to its substrates, enzymes are typically large with varying sizes, ranging from 62 amino acid residues to an average of 2500 residues found in fatty acid synthase. Only a small section of the structure is involved in catalysis and is situated next to the binding sites. The catalytic site and binding site together constitute the enzyme’s active site. A small number of ribozymes exist which serve as an RNA-based biological catalyst. It reacts in complex with proteins.
Also read: Amino acids
Enzymes Classification
Earlier, enzymes were assigned names based on the one who discovered them. With further research, classification became more comprehensive.
According to the International Union of Biochemists (I U B), enzymes are divided into six functional classes and are classified based on the type of reaction in which they are used to catalyze. The six kinds of enzymes are hydrolases, oxidoreductases, lyases, transferases, ligases and isomerases.
Listed below is the classification of enzymes discussed in detail:
| Types | Biochemical Property |
| Oxidoreductases | The enzyme Oxidoreductase catalyzes the oxidation reaction where the electrons tend to travel from one form of a molecule to the other. |
| Transferases | The Transferases enzymes help in the transportation of the functional group among acceptors and donor molecules. |
| Hydrolases | Hydrolases are hydrolytic enzymes, which catalyze the hydrolysis reaction by adding water to cleave the bond and hydrolyze it. |
| Lyases | Adds water, carbon dioxide or ammonia across double bonds or eliminate these to create double bonds. |
| Isomerases | The Isomerases enzymes catalyze the structural shifts present in a molecule, thus causing the change in the shape of the molecule. |
| Ligases | The Ligases enzymes are known to charge the catalysis of a ligation process. |
Oxidoreductases
These catalyze oxidation and reduction reactions, e.g. pyruvate dehydrogenase, catalysing the oxidation of pyruvate to acetyl coenzyme A.
Transferases
These catalyze transferring of the chemical group from one to another compound. An example is a transaminase, which transfers an amino group from one molecule to another.
Hydrolases
They catalyze the hydrolysis of a bond. For example, the enzyme pepsin hydrolyzes peptide bonds in proteins.
Lyases
These catalyze the breakage of bonds without catalysis, e.g. aldolase (an enzyme in glycolysis) catalyzes the splitting of fructose-1, 6-bisphosphate to glyceraldehyde-3-phosphate and dihydroxyacetone phosphate.
Isomerases
They catalyze the formation of an isomer of a compound. Example: phosphoglucomutase catalyzes the conversion of glucose-1-phosphate to glucose-6-phosphate (phosphate group is transferred from one to another position in the same compound) in glycogenolysis (glycogen is converted to glucose for energy to be released quickly).
Ligases
Ligases catalyze the association of two molecules. For example, DNA ligase catalyzes the joining of two fragments of DNA by forming a phosphodiester bond.
Cofactors
Cofactors are non-proteinous substances that associate with enzymes. A cofactor is essential for the functioning of an enzyme. The protein part of enzymes in cofactors is apoenzyme. An enzyme and its cofactor together constitute the holoenzyme.
There are three kinds of cofactors present in enzymes:
- Prosthetic groups: These are cofactors tightly bound to an enzyme at all times. FAD (flavin adenine dinucleotide) is a prosthetic group present in many enzymes.
- Coenzyme: A coenzyme binds to an enzyme only during catalysis. At all other times, it is detached from the enzyme. NAD is a common coenzyme.
- Metal ions: For the catalysis of certain enzymes, a metal ion is required at the active site to form coordinate bonds. Zinc is a metal ion cofactor used by a number of enzymes.
Examples of Enzymes
Following are some of the examples of enzymes:
Beverages
Alcoholic beverages generated by fermentation vary a lot based on many factors. Based on the type of the plant’s product, which is to be used and the type of enzyme applied, the fermented product varies.
For example, grapes, honey, hops, wheat, cassava roots, and potatoes depending upon the materials available. Beer, wines and other drinks are produced from plant fermentation.
Food Products
Bread can be considered as the finest example of fermentation in our everyday life.
A small proportion of yeast and sugar is mixed with the batter for making bread. Then one can observe that the bread gets puffed up as a result of fermentation of the sugar by the enzyme action in yeast, which leads to the formation of carbon dioxide gas. This process gives the texture to the bread, which would be missing in the absence of the fermentation process.
Drug Action
Enzyme action can be inhibited or promoted by the use of drugs which tend to work around the active sites of enzymes.
Also Read: Digestive Enzymes
Mechanism of Enzyme Reaction
Any two molecules have to collide for the reaction to occur along with the right orientation and a sufficient amount of energy. The energy between these molecules needs to overcome the barrier in the reaction. This energy is called activation energy.
Enzymes are said to possess an active site. The active site is a part of the molecule that has a definite shape and the functional group for the binding of reactant molecules. The molecule that binds to the enzyme is referred to as the substrate group. The substrate and the enzyme form an intermediate reaction with low activation energy without any catalysts.
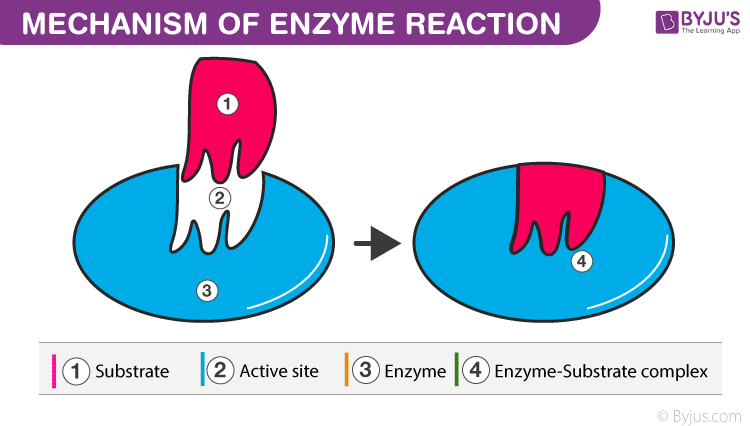
The basic mechanism of enzyme action is to catalyze the chemical reactions, which begins with the binding of the substrate with the active site of the enzyme. This active site is a specific area that combines with the substrate.
Enzyme-Substrate Interactions
Enzymes are biocatalysts, which are high molecular weight proteinous compounds. It enhances the reactions which occur in the body during various life processes. It helps the substrate by providing the surface for the reaction to occur. The enzyme comprises hollow spaces occupying groups such as -SH, -COOH, and others on the outer surface. The substrate which has an opposite charge of the enzyme fits into these spaces, just like a key fits into a lock. This substrate binding site is called the active site of an enzyme (E).
The favourable model of enzyme-substrate interaction is called the induced-fit model. This model states that the interaction between substrate and enzyme is weak, and these weak interactions induce conformational changes rapidly and strengthen binding and bring catalytic sites close enough to substrate bonds.
There are four possible major mechanisms of catalysis:
Catalysis by Bond Strain
The induced structural rearrangements in this type of catalysis produce strained substrate bonds that attain transition state more easily. The new conformation forces substrate atoms and catalytic groups like aspartate into conformations that strain substrate bonds.
Covalent Catalysis
The substrate is oriented to active place on the enzymes in such a manner that a covalent intermediate develops between the enzyme and the substrate, in catalysis that occurs by covalent mechanisms. The best example of this involves proteolysis by serine proteases that have both digestive enzymes and various enzymes of the blood clotting cascade. These proteases possess an active site serine whose R group hydroxyl generates a covalent bond with a carbonyl carbon of a peptide bond and results in the hydrolysis of the peptide bond.
Catalysis Involving Acids and Bases
Other mechanisms add to the completion of catalytic events which are launched by strain mechanisms such as the usage of glutamate as a general acid catalyst.
Catalysis by Orientation and Proximity
Enzyme-substrate interactions induce reactive groups into proximity with one another. Also, groups like aspartate are chemically reactive, and their proximity towards the substrate favours their involvement in catalysis.
Action and Nature of Enzymes
Once substrate (S) binds to this active site, they form a complex (intermediate-ES) which then produces the product (P) and the enzyme (E). The substrate which gets attached to the enzyme has a specific structure and that can only fit in a particular enzyme. Hence, by providing a surface for the substrate, an enzyme slows down the activation energy of the reaction. The intermediate state where the substrate binds to the enzyme is called the transition state. By breaking and making the bonds, the substrate binds to the enzyme (remains unchanged), which converts into the product and later splits into product and enzyme. The free enzymes then bind to other substrates and the catalytic cycle continues until the reaction completes.
The enzyme action basically happens in two steps:
Step1: Combining of enzyme and the reactant/substrate.
E+S → [ES]
Step 2: Disintegration of the complex molecule to give the product.
[ES]→E+P
Thus, the whole catalyst action of enzymes is summarized as:
E + S → [ES] → [EP] → E + P
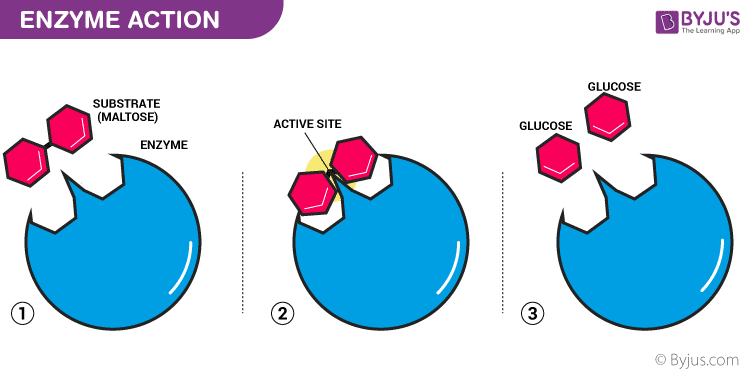
Biological Catalysts
Catalysts are the substances which play a significant role in the chemical reaction. Catalysis is the phenomenon by which the rate of a chemical reaction is altered/ enhanced without changing themselves. During a chemical reaction, a catalyst remains unchanged, both in terms of quantity and chemical properties. An enzyme is one such catalyst which is commonly known as the biological catalyst. Enzymes present in the living organisms enhance the rate of reactions which take place within the body.
Biological catalysts, enzymes, are extremely specific that catalyze a single chemical reaction or some closely associated reactions. An enzyme’s exact structure and its active site decide an enzyme’s specificity. Substrate molecules attach themselves at the active site of an enzyme. Initially, substrates associate themselves by noncovalent interactions to the enzymes which include ionic, hydrogen bonds and hydrophobic interactions. Enzymes reduce the reactions and activation energy to progress towards equilibrium quicker than the reactions that are not catalyzed. Both eukaryotic and prokaryotic cells usually make use of allosteric regulation to respond to fluctuations in the state inside the cells.
The nature of enzyme action and factors affecting the enzyme activity are discussed below.
Factors Affecting Enzyme Activity
The conditions of the reaction have a great impact on the activity of the enzymes. Enzymes are particular about the optimum conditions provided for the reactions such as temperature, pH, alteration in substrate concentration, etc.
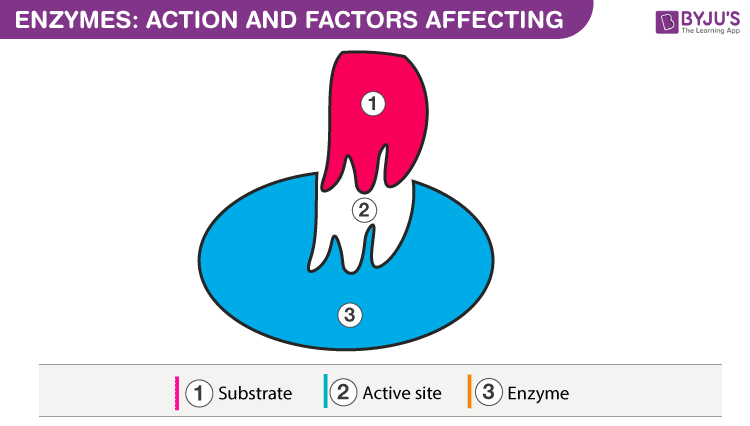
Typically, enzyme activities are accelerated with increasing temperatures. As enzymes are functional in cells, the feasible conditions for nearly all enzymes are temperatures that are moderate. At higher temperatures, given a specific point, there is a drastic decrease in the activity with the denaturation of enzymes. In diluted solutions, purified enzymes denature quickly compared to enzymes in crude extracts. Denaturation of enzymes can also take place when enzymes are incubated for long durations. More appropriate is to utilize a shorter time duration when it comes to incubation time to gauge the starting velocities of such enzyme reactions.
The International Union of Biochemistry suggests the standard assay temperature to be 30 °C. Almost all enzymes are extremely sensitive to pH change. Just some enzymes feasibly operate with pH above 9 and below 5. Most enzymes have their pH – optimum near to neutrality. Any alteration of pH causes the ionic state of amino acid residues to change in the whole protein and in the active site. The modifications in the ionic state can modify catalysis and substrate binding. The preference of substrate concentration is critical as at lower concentrations, the rate is driven by concentration, however, at high concentrations, the rate does not depend on any increase in the concentration of the substrate.
Active site
Enzymatic catalysis depends upon the activity of amino acid side chains assembled in the active centre. Enzymes bind the substrate into a region of the active site in an intermediate conformation.
Often, the active site is a cleft or a pocket produced by the amino acids which take part in catalysis and substrate binding. Amino acids forming an enzyme’s active site is not contiguous to the other along the sequence of primary amino acid. The active site amino acids are assembled to the cluster in the right conformation by the 3-dimensional folding of the primary amino acid sequence. The most frequent active site amino acid residues out of the 20 amino acids forming the protein are polar amino acids, aspartate, cysteine, glutamate, histidine, Serine, and lysine. Typically, only 2-3 essential amino acid residues are involved directly in the bond causing the formation of the product. Glutamate, Aspartate, and Histidine are the amino acid residues which also serve as a proton acceptor or donor.
Temperature and pH
Enzymes require an optimum temperature and pH for their action. The temperature or pH at which a compound shows its maximum activity is called optimum temperature or optimum pH, respectively. As mentioned earlier, enzymes are protein compounds. A temperature or pH more than optimum may alter the molecular structure of the enzymes. Generally, an optimum pH for enzymes is considered to be ranging between 5 and 7.
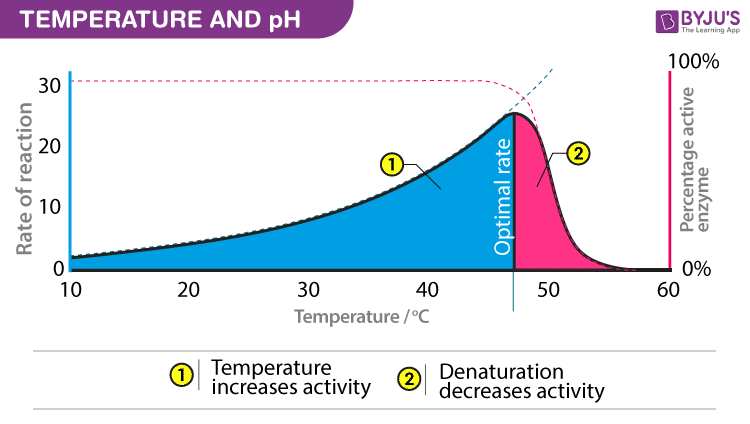
- Optimum T°
- The greatest number of molecular collisions
- human enzymes = 35°- 40°C
- body temp = 37°C
- Heat: increase beyond optimum T°
- The increased energy level of molecule disrupts bonds in enzyme & between enzyme & substrate H, ionic = weak bonds
- Denaturation = lose 3D shape (3° structure)
- Cold: decrease T°
- Molecules move slower decrease collisions between enzyme & substrate
Concentration and Type of Substrate
Enzymes have a saturation point, i.e., once all the enzymes added are occupied by the substrate molecules, its activity will be ceased. When the reaction begins, the velocity of enzyme action keeps on increasing on further addition of substrate. However, at a saturation point where substrate molecules are more in number than the free enzyme, the velocity remains the same.
The type of substrate is another factor that affects the enzyme action. The chemicals that bind to the active site of the enzyme can inhibit the activity of the enzyme and such substrate is called an inhibitor. Competitive inhibitors are chemicals that compete with the specific substrate of the enzyme for the active site. They structurally resemble the specific substrate of the enzyme and bind to the enzyme and inhibit the enzymatic activity. This concept is used for treating bacterial infectious diseases.
Salt concentration
Changes in salinity: Adds or removes cations (+) & anions (–)
- Disrupts bonds, disrupts the 3D shape
- Disrupts attractions between charged amino acids
- Affect 2° & 3° structure
- Denatures protein
- Enzymes intolerant of extreme salinity
- The Dead Sea is called dead for a reason
Functions of Enzymes
The enzymes perform a number of functions in our bodies. These include:
- Enzymes help in signal transduction. The most common enzyme used in the process includes protein kinase that catalyzes the phosphorylation of proteins.
- They break down large molecules into smaller substances that can be easily absorbed by the body.
- They help in generating energy in the body. ATP synthase is the enzyme involved in the synthesis of energy.
- Enzymes are responsible for the movement of ions across the plasma membrane.
- Enzymes perform a number of biochemical reactions, including oxidation, reduction, hydrolysis, etc. to eliminate the non-nutritive substances from the body.
- They function to reorganize the internal structure of the cell to regulate cellular activities.