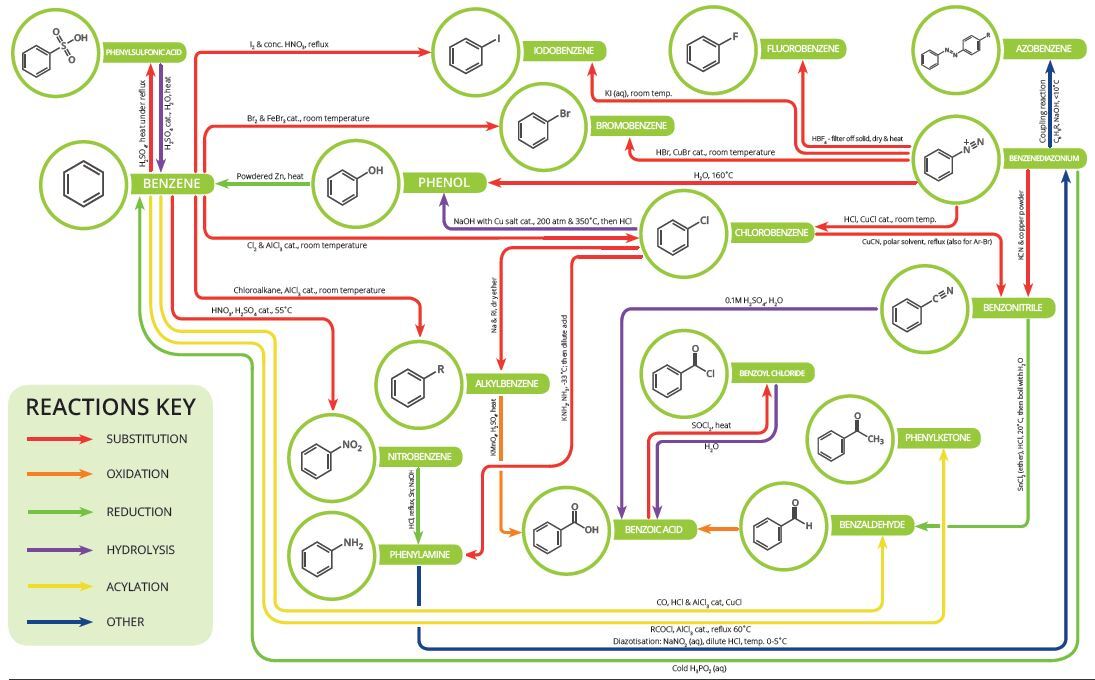
탄소는 다양한 결합을 만들어 낼 수 있는데, 그 이유는 14족 원소이기 때문이다.
14족 원소는 원자가 전자의 개수가 4개라서, 최대 4개의 결합이 가능하다.
또한, 탄소는 2주기 원소이기 때문에, 3주기의 Si나 4주기의 Ge 만큼 반지름이 크지 않아서 다중 결합을 쉽게 만들어 낼 수 있다.

생명의 원소 탄소(=C=), 탄소화합물 Carbon chemistry
화합물의 backbone
- 탄소는 Super flex : 요술쟁이 네 개의 팔로 온갖 조화 부린다.
- 탄소는 Super power : 가장 단단한 구조물을 만든다
- CH : 탄화수소
- CHO : 지방, 탄수화물,유기산
- CHONS : 단백질
- CHONSP : 핵산, ATP
탄소는 지금까지 존재가 확인된 114종의 원소 중에서 6번째로 가벼운 원소다. 아득한 옛날 태양보다 큰 별들이 수명을 다할 때 일어나는 초신성 폭발 과정에서 만들어진 탄소가 지천으로 널려있는 것은 아니다. 탄소는 태양 질량의 0.29%에 불과하고, 지구에서도 12번째로 흔한 원소일 뿐이다. 그렇다고 탄소를 함부로 여길 수는 없다. 탄소가 나타내는 놀라운 수준의 화학적 다양성 때문이다. 지금까지 알려진 7000만 종이 넘는 화학물질 중 절대다수가 탄소로 만들어진 것이다. 서열과 구조가 분명하게 확인된 단백질과 DNA의 수도 6000만 종이 넘는다.

탄소(carbon, 원소기호 C)는 석탄을 뜻하는 라틴어인 카르보(carbo)에서 유래한다.
외각전자가 4개라는 사실은 탄소가 다른 어떤 원소보다 다양한 화합물을 만들 수 있다는 가능성을 나타낸다. 지금까지 알려진 1천만 종에 가까운 화합물 가운데 탄소가 다른 원소와 결합해 이뤄진 화합물이 대부분을 차지하고 있으니 그 다양성이 어느 정도인지 짐작할 수 있을 것이다. 이렇게 탄소와 결합한 화합물을 탄소화합물 또는 유기화합물이라고 한다.
1807년 스웨덴의 화학자 베르젤리우스는 물질을 유기물과 무기물로 구별했다. 유기물은 무기물과 달리 생물체 중에 있는 생명력과 관계가 있다고 믿었다. 이를 생기론(Vitalism)이라고 한다. 베르젤리우스는 유기화합물은 생물체의 생명력에 의해서만 만들어지는 것으로 동식물의 체내에만 존재하고 인공적으로 합성할 수 없다고 생각했다.
이렇듯 엄청난 수의 탄소화합물이 만들어질 수 있는 중요한 이유는 탄소가 수소, 질소, 산소, 황 등의 비금속 원소와 안정한 공유결합 화합물을 만들기 때문이다. 또 탄소가 다른 원자와 결합할 수 있는 최외각 전자가 4개라는 사실과 적절한 크기(0.077nm)를 갖고 있는 것도 다양한 화합물을 만들 수 있는 중요한 이유다.
탄소와 같이 4개의 외각전자를 가지고 있지만 크기가 0.118nm으로 너무 커서 탄소처럼 온갖 조화를 부리기 어려운 원소가 바로 규소(Silicone, Si)다.
또 탄소화합물은 탄소의 수가 증가할수록 사슬 모양, 가지모양, 고리 모양 등의 다양한 구조를 만들 수도 있다. 만약 과학자들이 조물주가 돼 새로운 생명체를 탄생시킨다면 무엇보다도 탄소를 이용할 것이라고 하는 이유도 여기에 있다.
생명의 원소인 탄소는 지구 환경에서 생명현상을 유지하기 위해 다음과 같은 여러 생명조건을 충족하고 있다.
첫째 생체 구성물은 에너지를 함유하고 전환하는 작업이 용이해야 한다.
둘째 생체 구성물의 조립과 분해가 용이해야 한다.
셋째 생체 구성물은 구조적 다양성을 수용할 수 있어야 한다.
넷째 생체 정보인 두뇌정보, 유전정보, 구조정보 등을 수용하고 처리할 능력이 있어야 한다.
다섯째 지구상에 풍부하게 존재해야 한다.
탄소하면 대부분의 사람들이 석탄을 떠올리는 것은 어쩌면 당연할지도 모르겠다. 하지만 석탄은 탄소덩어리의 가장 초보적인 모습에 불과하다. 석탄은 단지 연료로만 사용되는 것이 아니다. 석탄에서는 비닐론과 같은 합성섬유의 원료도 나오고 또 비료나 온갖 귀중한 의약품을 만드는데 유용하게 쓰인다. 공업에서 중요한 또 하나의 원료는 원유다. 사람들은 생활의 에너지원인 원유를 떠올리면서도 이 원유가 탄화수소의 혼합물이라는 사실은 잊고 있는 듯하다. 원유에는 탄소가 83-87%, 수소가 11-17% 들어있고 나머지는 산소, 질소, 황 등으로 돼 있다. 그렇다면 이러한 원유들이 많은 탄소를 함유한 까닭은 무엇일까. 그것은 바로 아주 먼 옛날 동식물과 같은 유기체가 지각 변동이나 자연조건의 변화로 땅속에 묻혀 오랜 세월이 흐르면서 원유로 변했기 때문이다.
이밖에도 주변에서 볼 수 있는 아름다운 꽃이나 나무, 동물들, 사람들의 기본 골격을 구성하고 있는 것도 탄소이고, 우리가 입고 다니는 옷도 탄소로 이뤄진 화합물이다. 즉 1371년 문익점이 목화를 심기 시작한 때부터 입었던 무명천, 1935년 나일론이 처음 만들어졌을 때부터 입고 있는 수십 종의 합성섬유가 모두 탄소화합물이다.
또 우리가 사용하는 플라스틱 그릇, 가구, 음식들에도 모두 탄소가 포함돼 있다. 뿐만 아니다. 담배의 필터 부분을 보자. 흡착성이 뛰어난 차콜이라는 까만 알갱이는 담배가 연소될 때 발생하는 유해 기체들을 흡착한다. 또 우리가 먹는 까만 설탕도 탄소를 통과하면 흰 설탕으로 바뀐다. 강이 오염됐다는 소식이 있으면 제일 먼저 출동하는 것이 탄소로 이뤄진 활성탄들이다. 또 배탈이 났을 때 지사제로 쓰이는 약의 주성분은 탄소다. 이밖에도 가볍고 강도 높은 재료를 필요로 하는 스포츠용품에는 거의 탄소가 약방의 감초처럼 끼어있다. 근래에는 우주선의 전지에서부터 각종 부속품을 포함한 몸체까지 탄소가 포함되지 않은 곳이 없다. 사람들은 산소가 없으면 곧 죽을 것처럼 떠든다. 하지만 정작 탄소가 없으면 죽는다는 것을 알고 있을까. 도대체 탄소는 어떤 원소이기에 보이지 않게 이 세계를 움직이고 있는 것일까.
4개의 전자가 외각전자로 있다. 이들 외각전자가 어떤 배치를 하느냐에 따라 흑연이 될 수도 있고 다이아몬드가 될 수도 있다. 4개의 전자가 공유결합을 위한 팔을 뻗어 정사면체의 꼭짓점에서 다른 탄소와 결합을 하면 전기전도성이 없는 다이아몬드가 된다. 물론 결합력은 강해 경도가 높다.
반면 흑연은 4개의 전자 중 3개는 평면에서 1백20도로 결합할 수 있는 팔을 만들고 나머지 한 개의 전자는 평면에 수직으로 팔을 뻗어 다른 탄소와 결합돼 있다. 동일 평면상에서 결합돼 있는 힘은 매우 강하나 아래위에 겹쳐져 있는 면들 간의 결합은 약하다. 따라서 흑연층 간의 결합은 파괴되기 쉽고 윤활성이 좋다. 이러한 성질을 이용한 것이 연필심과 같은 것이다.
흑연의 평면에 수직 된 방향으로 결합을 이루고 있는 전자는 평면을 따라 쉽게 움직일 수 있어서 흑연은 전기를 잘 통하는 물질이 된다. 이런 전자들은 가시광선 영역의 빛을 모두 흡수하기 때문에 흑연을 비롯한 탄소재료의 대부분이 검은색을 띤다. 반면 다이아몬드는 탄소의 외각전자들이 모두 탄소와 탄소 사이에 묶여있어서 가시광선을 흡수하지 못하기 때문에 투명하게 보이는 것과 비교가 된다.
결합하는 방법에 따라 흑연과 다이아몬드로 그 운명을 달리한 탄소가 근래 들어서는 또 다른 모습으로 현대의 과학자들을 흥분시키고 있다. 그들은 다름 아닌 풀러렌(Fullerene)과 탄소나노튜브. 이들은 나노테크놀로지의 선두 주자로 초전도체나 집적도가 어마어마한 반도체로서 각광을 받고 있다.

생명체는 왜 탄소를 택하였는가?
→ 탄소는 지구상에서 13번째로 많은 원소이지만 지구전체를 놓았을 때는 0.2%밖에 되지 않는다 탄소화합물은 다른 원소로 이루어진 화합물의 수보다도 많습니다. 이는 탄소의 성질이 새로운 화합물을 만들기 위해 그 어떠한 원소보다도 용이하다는 말이다.
어떠한 성질 때문에 화합물을 만드는데 용이하다는 것일까?
우선 탄소는 공유결합(covalent bond)을 하는데 최적의 조건을 가지고 있으며 생명체를 이루는 다른 원자들 특 수소. 질소. 산소. 황, 등의 비금속 원소와 안정한 공유결합 화합물을 만들 수 있다. 여기서 공유결합이란 2개의 원자들이 원자가전자(valence electron)의 전자쌍을 서로 공유하여 결합을 이루는 상태라고 말할 수 있다. 그런데 탄소는 가장 바깥 껍질에 4개의 전자들을 가지고 있다. 이 4개의 전자들이 옥텟(octet) 규칙에 의하여 다른 원소들의 각각의 전자들과 4번의 공유결합을 할 수 있게 된다. 그러나 이러한 의문을 가질 수 있을 것이다. “생명체들은 왜 공유결합이 필요하며, 원소들은 그냥 가만히 있을 것이지 공유결합을 하려고 하는 것인가?” 생명체에게 공유결합이 필요한 이유는? 화학결합의 종류는, 이온결합, 공유결합, 배위결합, 수소결합들이 있는데 이중 생명체에서 적합한 화학결합은 이온결합과 공유결합 두 개로 꼽을 수 있는데 세포 속의 물 때문에 이온결합은 결합이 쉽게 부서지는 경향이 있어서 생명체에서의 가장 적합한 화학결합은 공유결합이라고 말할 수 있는 것이다. 원소들은 왜 공유결합을 하려고 하는 것인가? 그 이유는 원자핵 주위를 돌고 있는 전자들 중에서 가장 바깥껍질에 있는 전자(원자가 전자)가 8개 일 때 매우 안정한 상태가 된다. 여러분들은 안정한 상태이고 싶은가 아니면 불안정하고 싶은가? 누구에게 물어보아도 편하고 행복한 안정한 상태가 되고들 싶을 것이다. 아마도 원자 역시 안정하고 싶을 것이다. 그러니 안정한 상태인 원소들(불활성 기체)을 빼고는 모든 원자들 역시 원자가 전자 8개 이도록 만들고 싶을 것이다. 그래서 공유결합을 할 수 있다. 이것이 옥텟규칙이다. 본론으로 되돌아와서 즉, 탄소가 4번의 공유결합을 할 수 있다. 그러면 가장 바깥껍질에 4개의 전자를 가지고 있는 원소들 특 14족 원소들 규소, 저미늄, 주석, 남도 탄소와 같이 최적의 공유결합을 할 수 있는 요소들이라고 할 수 있다. 하지만 규소 다음부터인 저미늄부터는 금속이며 옥뎃규칙은 d오비탈 이상이 되면 옥텟규칙이 거의 작용하지 않는다고 봐야 된다.
규소가 아닌 탄소가 선택받은 이유는?
첫 번째 특징은 위 규소의 특징과 같이 규소는 탄소보다 큽니다.
약 탄소의 크기는 0.077mm 정도이며 규소의 크기는 0.118mm 정도라고 합니다. 0.041의 크기 차이인데 규소는 거의 탄소의 절반정도가 더 크다는 말인데 이렇게 규소가 크면 상대적으로 다른 원소들과 다양한 결합을 하기 힘들어지며 결합을 통하여 형성된 화합물들이 세포를 이룰 때 그 크기가 상대적으로 비대해질 거라고 봅니다. 세포의 가장 큰 특징인 “작다 왜? 부피에 비해서 표면적이 늘어나닌까”라는 특징에 규소는 효율적이지 못합니다.
뭐 그러면 생물체 전체가 모두 커지면 되지 않겠느냐라고 생각할 수 있습니다. 그럼 두 번째 특징을 한번 보겠습니다.
두 번째 특징은 규소화합물은 탄소화합물보다 결합강도가 강합니다.
결합강도가 강하면 좋은 것이 아니냐? 뼈도 잘 안 부러지고 잘 다치지도 않으며 강한 힘을 낼 수도 있고 수명도 길어지겠지요 하지만, 반대로 생각해 보면 생체구성물의 조립과 분해가 용이하지 않으며 필요치 않고 해가 되는 물질들은 없어 버려야 하는데 그러지 못하게 됩니다. 뿐만 아니라 대사 작용 시 생산되는 ATP 가지고 에너지를 사용하는데 ATP 생산과정에서 링크를 끊음으로 인하여 에너지를 생산시키는데 그 링크를 부수지 못하여 에너지 생산에 차질이 생기게 되며 그 외 세포분열, 단백질합성 등 모든 생명현상에서는 모두 탄소를 끊었다 붙였다 하며 여러 대사 작용을 하는데 결합강도가 높아져서 결합되지도 끊어지지도 않는다면 DNA생성, 단백질 합성, 성장, 생식 등 어떠한 생명현상도 일어나지 않을 것입니다.
마지막 세 번째 상온에서의 규소와 탄소의 성질 때문입니다.
탄소-산소 즉, Co₂는 기체로 존재하고 있는 반면에 규소-산소 화합물은 상온에서 고체로 존재하기 때문입니다. Co₂즉 이산화탄소는 1차 생산자인 식물에서 에너지 소스로 섭취가 가능하지만 규소-산소 화합물인 석영은 식물이 에너지 소스로 사용하려면 석영을 잘게 부수어서 사용하여야 하는데 식물에게는 잘게 부수는 능력이 없지요. 그러면 규소-산소 화합물을 기체로 섭취하려면 되어야 한다면 평균온도는 몇 백도가 되어야 할 것입니다. 이러한 환경에서는 생명체가 살 수 없을 것입니다.
즉, 규소는 탄소보다 크고, 결합강도가 높으며, 상온에서 고체 상태를 이룹니다.
이러한 세 가지의 이유로 인하여 규소는 비록 원자가 전자가 4개여서 효율적인 공유결합을 이루어도 생명현상을 이루기에는 적합하지 못하는 이유겠지요.
C-14
우리 몸 안에 탄소는 18%, 칼륨은 0.35%
탄소가 칼륨보다 양으로는 51배 숫자로는 147배나 많다
탄소(C-14)의 반감기는 5700년 칼륨(K-40)은 12.8억 년
탄소가 2만 배 이상 빨리 터진다
만약에 방사성 원소가 동일 비율로 있으면
탄소가 칼륨보다 100만 배나 많은 내부 피폭을 일으킬 텐데
다행히 방사성 탄소는 훨씬 적기 때문에
그 양이 절반 정도다
그리고 그 방사선 탄소는 주로 태양이 만든 것이다.
태양이 만든 우주선이 공기의 80%를 차지하는
질소의 극히 일부를 방사선 탄소로 만든다
매년 7.5kg를 꾸준히 만들기 때문에
모든 생명체는 태어난 시기에 관계없이
일정한 비율을 방사선 C-14를 가지게 된다
그리고 그 사실을 바탕으로
1만 년 이전의 생명체의 나이를 측정하기도 한다
[이덕환의 과학세상] 탄소에 대한 저주, 도 넘었다
2022.12.07 13:37
지구를 뜨겁게 달아오르게 만들고 있는 ‘탄소’에 대한 사회적 거부감이 심각하다. 지구촌의 산업현장과 일상생활에서 탄소를 퇴출시켜 버려야 한다는 목소리가 국제 사회에서 상당한 설득력을 얻고 있다. 탄소를 줄이자는 ‘저탄소’(low carbon)와 탄소 없는 세상을 만들자는 ‘탈탄소’(carbon free)가 그런 요구였다. 이제는 탄소를 아예 배출하지 않거나, 어쩔 수 없이 배출하는 탄소도 다시 회수해야 한다는 ‘탄소 중립(carbon neutral 또는 net zero)'이 대세다.
실제로 많은 사람들이 탄소를 ‘악마’로 인식하고 있다. 탄소가 심각한 기후변화, 식량 생산 감소, 물 부족, 환경 파괴 등을 일으키는 지구 온난화의 원흉이라고 믿는다. 심지어 지난 3년 동안 전 세계를 무겁게 짓누르고 있는 코로나19 팬데믹도 탄소 때문이라는 목소리도 있다. 서식지를 빼앗긴 박쥐가 인간에게 보복하는 과정에서 팬데믹이 발생했다는 것이다.
물론 기후 변화를 걱정하는 환경주의자들이 들먹이는 ‘탄소’는 화학에서 사용하는 원자번호 6번의 ‘탄소’가 아니다. 오히려 지구온난화를 일으키는 악당으로 알려지고 있는 ‘이산화탄소’를 말한다. ‘탄소’와 ‘이산화탄소’의 구분은 화학자들에게나 필요한 것이라고 우긴다. 역시 지구의 대기를 뜨겁게 만드는 온실가스인 수증기‧메탄(천연가스)‧암모니아‧오존 때문에 발생하는 문제는 애써 외면해 버린다. 이산화탄소가 녹색 식물을 살아 숨 쉬도록 해준다는 사실도 무시한다.
○ 탄소는 생명의 원소
우리의 맹목적인 저주와 달리 탄소는 생명의 원소다. 탄소가 없으면 생명 현상 자체가 불가능하다. 생명체의 조직과 기관을 구성하고, 복잡하고 정교한 생리 현상을 가능하게 해 주고, 후손에게 유전 정보를 전달해 주는 모든 일이 탄소의 화합물에 의해서만 가능하기 때문이다. 지구상에서만 그런 것이 아니다. 우주의 어느 곳엔가 존재하는 것으로 추정되는 외계 생명(ET)도 역시 탄소에 의존할 수밖에 없다. 현대 화학과 생명과학이 밝혀낸 엄중한 과학적 진실이다.
탄소는 세상에서 6번째로 가볍고 작은 원소이다. 그런 탄소의 화학적 다양성은 놀라운 수준이다. 지금까지 화학적으로 확인되어 미국화학회의 CAS에 등록되어 있는 화합물의 70% 이상이 탄소의 화합물이다. 대부분의 탄소 화합물은 생명과 직접적으로 관련되어 있다. 지금까지 확인된 생명 현상과 직접 관련된 단백질과 DNA의 종류만 해도 6000만 종이 넘는다. 모두가 탄소의 독특한 양자역학적 성질 덕분이다.
실제로 탄소는 다양한 화학적 상태로 존재한다. 2개의 산소와 결합된 ‘이산화탄소’가 산화 상태 +4의 낮은 에너지를 가진 가장 안정한 상태이다. 모든 탄소의 화합물은 궁극적으로 산소와 결합하는 ‘산화(酸化)’ 과정을 통해서 가장 안정한 이산화탄소로 전환된다. 생명이 존재하지 않은 행성의 대기에 남아있는 탄소는 대부분 이산화탄소로 존재하는 것도 그런 이유 때문이다. 수성과 금성의 대기가 그렇다. 지구의 대기에서 이산화탄소를 포집‧활용하는 일이 쉽지 않은 것도 이산화탄소의 에너지 안정성 때문이다.
지구상의 생태계는 다양한 산화 상태의 탄소 화합물을 만들어낸다. 녹색식물이 햇빛을 이용해서 공기 중 이산화탄소를 부분적으로 환원시켜서 만들어내는 다양한 탄수화물과 메탄을 비롯한 탄화수소가 대표적이다. 동물은 식물이 만들어준 탄수화물을 다시 이산화탄소로 산화시키는 과정에서 얻은 화학적 에너지로 살아간다. 그것이 바로 자연 생태계에 숨겨져 있는 생명에 의한 ‘탄소 순환(carbon cycle)’이다. 결국 지구 생태계는 이산화탄소에 의해서 유지되고 있는 것이다.
탄소가 우주 공간이나 지구에 지천으로 널려있는 것은 아니다. 탄소는 우주 공간을 가득 채우고 있는 별에서 일어나는 핵융합 반응에서 만들어지는 원소들 중 하나이다. 태양보다 큰 별이 죽어가는 과정에서 일어나는 초신성(超新星) 폭발에서도 만들어진다. 그런 탄소가 태양보다 큰 별에서 일어나는 핵융합을 가능하게 만들어주는 촉매(觸媒) 역할을 한다. 그런 탄소·질소 순환과정(C-N cycle)을 밝혀낸 한스 베테는 1967년에 노벨 물리학상을 받았다.
태양에 존재하는 탄소의 양은 전체 질량의 0.29%에 지나지 않는다. 지구의 지각에서도 탄소는 산소‧규소(실리콘)‧알루미늄‧철 등에 이어 17번째로 흔한 원소일 뿐이다. 그런데 생명체의 경우에는 사정이 다르다. 우리 몸의 18%가 탄소이다. 우리 몸무게의 70%를 차지하는 물을 구성하는 산소를 빼고 나면, 탄소가 압도적으로 많은 양을 차지한다. 탄소가 생명의 진정한 ‘아르케’라는 또 다른 근거이다. 물이 생명의 근원이라는 동서양의 고대 사상은 과학적 근거를 찾기 어려운 억지였을 뿐이다.
인간을 비롯한 동물은 음식으로 섭취한 부분적으로 환원된 탄소 화합물을 이용해서 조직과 기관을 만들고, 그 에너지를 이용해서 생명 현상을 이어간다. 실제로 우리 몸을 구성하는 60조 개의 세포가 모두 탄소의 화합물로 만들어진 것이다. 우리 몸에서 일어나는 생리작용을 정교하게 통제해 주는 효소와 호르몬과 같은 단백질도 탄소의 화합물이다. 우리가 살아 움직이기 위해 필요한 생리적 에너지를 공급해 주는 탄수화물이나 지방도 예외가 아니다. 심지어 생명의 연속성에 꼭 필요한 유전 정보를 담고 있는 DNA와 유전 정보로부터 단백질을 합성하는 과정에서 핵심적인 역할을 하는 RNA도 탄소의 화합물이다.
탄소 화합물을 생명을 가진 유기체의 전유물이라는 뜻에서 ‘유기물(有機物)’이라고 부르기도 했다. 1828년 독일 화학자 프리드리히 뵐러가 실험실에서 화학적인 방법으로 탄소의 화합물인 요소(尿素)를 합성하는 일에 성공하면서 생명에 대한 화학적 연구가 본격적으로 시작되었다. 유기체의 몸속에서만 만들어진다고 믿었던 유기물이 사실은 실험실에서도 볼 수 있는 평범한 화학반응의 결과라는 놀라운 사실을 밝혀낸 것이었다.
○ 탄소는 문명의 원소
탄소는 인류 사회의 경제적, 문화적 발전을 가능하게 만들어준 원동력이기도 하다. 인류 문명은 흔히 청동이나 철과 같은 소재를 근거로 구분한다. 그러나 그런 시대적 구분도 탄소로 구성된 식량‧섬유‧염료‧의약품‧목재‧종이의 생산이 전제되어야만 의미가 있는 것이다. 더욱이 청동기와 철기 시대는 장작과 같은 임산연료를 가공한 탄소 덩어리인 ‘숯’(charcoal)을 사용하기 시작하면서 가능해졌다. 인류 문명의 근대화를 가능하게 만들어준 화석 연료도 모두 탄소의 화합물이다. 정보화 시대를 가능하게 만들어준 전기도 대부분 석탄을 비롯한 화석 연료로 생산했다. 탄소를 이용해서 생산하는 에너지가 인류 문명의 눈부신 발전을 가능하게 만들어주었던 것이다.
19세기 중반부터 인류의 탄소 의존도는 더욱 빠르게 심화되었다. 천연물에 의존하던 염료‧섬유‧의약품을 인공적으로 합성하는 효율적인 화학 기술이 등장했다. 20세기에는 탄소를 기반으로 하는 고분자 합성 기술이 등장했고, 이제는 미래의 소재로 전망되는 탄소 기반의 첨단 나노 소재가 개발되고 있다. 탄소의 다양성을 활용하는 기술은 앞으로도 더욱 높은 수준으로 발전할 것이 분명하다. 탄소의 활용을 포기해 버리면 인류의 삶은 야생의 짐승들 수준의 수렵채취 시대로 되돌아갈 수밖에 없다.
○ ‘탄소문화’가 진정한 친환경
탄소는 인간의 존재와 인류 문명을 가능하게 만들어준 가장 현실적인 수단이다. 게티이미지뱅크 제공
지구 온난화가 우리의 과도한 화석 연료 소비 때문이라고 한다. 그렇다고 오늘날 우리의 생존을 위협하는 모든 경제‧사회‧정치‧문화‧보건의 문제가 탄소 때문이라는 주장은 근거가 턱없이 부족한 억지일 수밖에 없다. 지난 한 세기 동안 환경 문제를 소홀히 여기고 화석 연료를 마구 써버린 우리 자신의 실수를 엉뚱하게 탄소의 탓으로 돌려버리려는 자세는 매우 비겁한 것이다.
탄소가 우리의 무분별한 소비와 낭비를 부추긴 것도 아니다. 화석 연료의 소비를 줄이고, 이산화탄소의 배출을 줄이면 반드시 지구 온난화가 해결되는 것도 아니다. 지구의 대기는 화학적 평형에서 멀리 떨어져 있는 복잡계이고, 그런 계에서 일어나는 변화는 비가역적(irreversible) 일 수밖에 없다. 결국 화석 연료의 사용을 포기한다고 지구가 다시 식어서 정상으로 돌아올 것이라는 기대는 순진한 것일 뿐이다.
사실 우리가 변화하는 기후를 되돌릴 수 있는 초월적 능력을 가지고 있는 것은 아니다. 우리가 거대한 자연의 도도한 변화를 막아낼 수 있다는 생각은 비현실적이고 기술만능주의적인 착각일 뿐이다.
놀라운 과학 지식과 기술력에도 불구하고 우리 인간은 여전히 연약한 존재일 뿐이다. 우리가 거대한 자연의 변화를 함부로 바꿀 수 있는 능력을 가지고 있는 것이 절대 아니다. 오히려 과도한 자연 의존도를 줄여서 자연 생태계로부터의 자립을 꿈꾸면서 자연의 변화에 현명하게 ‘적응(適應)’하기 위해 노력할 수 있을 뿐이다. 탄소에 대한 공연한 악마화와 거부감이 자칫 우리의 절박한 노력에 독(毒)으로 작용할 수도 있다는 겸손한 인식이 필요하다.
탄소는 우리가 거부해야 할 악(惡)이 아니라, 적극적으로 수용해야 할 선(善)으로 규정할 수밖에 없다. ‘탄소의 과학’이라고 할 수 있는 화학을 포함한 현대 과학과 기술이 인간의 정체성 확인과 문명 발전의 견인차 역할을 해왔고, 앞으로도 그런 사실은 변하지 않을 것이다. 현대 과학이 인간의 문제를 고민하는 인문‧사회‧문화‧예술과의 적극적인 융합을 위해 노력해야 하는 것도 그런 이유 때문이다.
현대의 과학기술문명을 적극적으로 활용해서 인류의 지속적인 생존과 번영을 위한 새로운 ‘탄소문화’(carbon culture)의 창달을 위해 노력하는 것이 우리에게 주어진 막중한 시대적 당위다. 특히 현대 과학기술의 가치와 성과를 분명하게 평가해서 인정하고, 적극적으로 수용하는 친(親) 탄소적이고, 친(親) 과학적인 자세가 무엇보다 중요하다. 탄소가 인간의 존재와 인류 문명을 가능하게 만들어준 가장 현실적인 수단이었다는 사실은 아무도 부정할 수 없는 역사적‧과학적 진실이다.