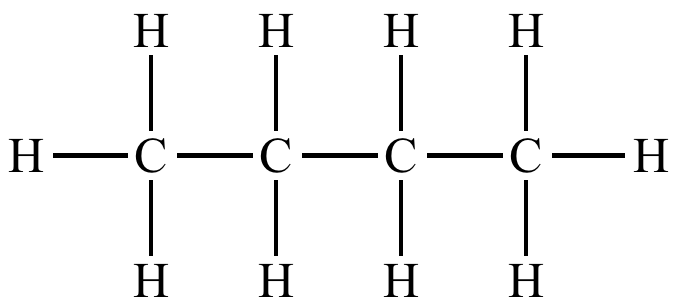
탄화수소, 炭化水素, Hydrocarbon
탄소 화합물의 일종으로 탄소와 수소로만 이루어진 유기 화합물이다. 가장 간단한 탄화수소로는 메테인(CH4)이 있다. 주로 가스의 원료로 쓰이며, 탄소 원자의 개수가 많을수록 분자 간의 인력이 증가해 끓는점이 높아진다.
탄화수소 결합은 비극성 공유 결합이므로 탄화수소는 극성이 약하거나 없다. 따라서 극성 물질인 물에 대해 소수성을 갖는다.

탄화수소 분류
사슬 모양 탄화수소와 고리 모양 탄화수소
탄소 결합이 고리 모양을 이루는 사이클로알케인, 사이클로알켄, 방향족 탄화수소 등은 고리 모양 탄화수소라고 부르며, 그 외 선형으로 이루어진 탄화수소는 사슬 모양 탄화수소라고 부른다. 분자 내 사슬 형태와 고리 형태가 모두 있는 탄화수소 역시 존재한다.
포화 탄화수소와 불포화 탄화수소
단일 결합으로만 이루어진 알케인과 사이클로알케인은 포화 탄화수소로, 그 외 다중 결합이 하나 이상 있는 탄화수소들은 불포화 탄화수소로 분류된다. 벤젠 고리를 갖는 구조 역시 불포화 탄화수소이다.
방향족 탄화수소와 지방족 탄화수소
벤젠 고리가 있는 탄화수소는 방향족 탄화수소로 분류하며, 벤젠 고리가 없으면 지방족 탄화수소로 분류한다.
탄화수소 명명법
알케인/알킬기(RH) : 단일결합 탄소-수소 사슬. 알킬- 이라는 접두사나 -에인이라는 접미사가 붙는다.
알켄/알케닐기(R1=R2) : 이중결합 탄소-수소 사슬. 알케닐- 이라는 접두사나 -엔이라는 접미사가 붙는다.
알카인/알카이닐기(R1≡R2) : 삼중결합 탄소-수소 사슬. 알카이닐- 이라는 접두사나 -아인이라는 접미사가 붙는다.
사이클로알케인 : 탄소 고리 모양으로 단일결합만으로 이루어져 있으며 사이클로- 라는 접두사와 -에인이라는 접미사가 붙는다.
사이클로알켄 : 탄소 고리 모양으로 이중결합 하나가 있고 이중결합을 제외하고 단일결합으로 이루어져 있으며 사이클로- 라는 접두사와 -엔이라는 접미사가 붙는다.
사이클로알카인: 탄소 고리 모양으로 삼중결합 하나가 있고 나머지는 단일결합이다. 사이클로알케인과 사이클로알켄은 3개만으로도 충분히 안정적으로 존재할 수 있는 것과 달리, 사이클로알카인은 안정적으로 존재하려면 적어도 8개의 탄소가 필요한 것으로 알려져있다.
방향족(RC6H5/RPh) : 벤젠 고리가 있는 화합물. 페닐- 이라는 접두사나 -벤젠이라는 접미사가 붙는다.
|
탄소 개수
|
명칭
|
탄소 개수
|
명칭
|
탄소 개수
|
명칭
|
|
1
|
Meth-
|
20
|
Cos-
|
10n+1
|
Un-/Hen-
|
|
2
|
Eth-
|
30
|
Triacont-
|
10n+2
|
Do-
|
|
3
|
Prop-
|
40
|
Tetracont-
|
10n+3
|
Tri-
|
|
4
|
But-
|
50
|
Pentacont-
|
10n+4
|
Tetra-
|
|
5
|
Pent-
|
60
|
Hexacont-
|
10n+5
|
Penta-
|
|
6
|
Hex-
|
70
|
Heptacont-
|
10n+6
|
Hexa-
|
|
7
|
Hept-
|
80
|
Octacont-
|
10n+7
|
Hepta-
|
|
8
|
Oct-
|
90
|
Nonacont-
|
10n+8
|
Octa-
|
|
9
|
Non-
|
|
|
10n+9
|
Nona-
|
|
10
|
Dec-
|
|
|
|
|
10n+a 형태에 붙는 접두사가 더 앞에 온다.
ex) 탄소가 12개인 알케인 → 도데케인(Dodecane)
ex) 탄소가 36개인 알데하이드 → 헥사트리아콘탄알(Hexatriacontanal)
극성, 極性, polarity

화학에서 이중극자 혹은 그 이상의 다중극자를 갖는 분자나 분자단에서 나타나는 전하의 분리를 의미한다. 일반적으로 두 개 이상의 원자로 이루어진 분자의 구조적 비대칭성이나 구성 원자간의 전기 음성도 차이에 의하여 전자구름이 한 방향으로 몰려서 생겨나는 전기 쌍극자 모멘트로 표현하기도 한다. 극성은 비교적 고정되어 있으며 정전기적 인력에 의한 이중극자간 상호작용 혹은 수소 결합 등을 통해 극성 분자 간의 상호작용이 일어난다. 용해도, 녹는점, 끓는점 등의 분자의 다양한 물리적 성질을 설명하는데 사용된다. 양전하를 띠는 원자핵이 얼마나 노출되었는지를 지표로 사용하기도 한다.
극성을 표현하기 위해서 분자에서 전기 음성도가 크거나, 구조적으로 전자 구름이 몰려있는 쪽을 델타 마이너스(δ-), 그 반대편을 델타 플러스(δ+)로 간단하게 표현하기도 한다.
무극성 또는 비극성이란 극성이 매우 적거나, 심하게는 없는 것을 말하는 것으로 이러한 무극성 분자는 극성 분자에 비해 일반적으로 분자 간의 인력이 적으며 반데르 발스의 힘이라는 유사 극성으로 결합력을 강화하기도 한다. 분자의 구조가 대칭형인 분자들은 무극성이다. 무극성 분자 역시 무극성 분자끼리의 용해성이 크다
| 극성 분자 | 무극성 분자 | |
| 분자 내 전자 분포 | 전자가 고르게 분포되어 있지 않다. | 전자가 고르게 분포되어 있다. |
| 물에 대한 용해도 | 물에 매우 잘 녹는다. 친수성(親水性, Hydrophile) |
물에 잘 녹지 않는다. 소수성(疏水性, Hydrophobe) |
| 예 | H2O(물), HCl(염화수소), NH3(암모니아), C2H5OH(에탄올), 설탕, 이산화황, 이산화 질소 | CO2(이산화탄소), O2(산소), N2(질소), I2(아이오딘), C6H6(벤젠), CH4(메탄), CCl4(사염화탄소), 헥산 |
친수성(親水性, Hydrophile)
물 분자와 쉽게 결합되는 성질을 의미한다. 일반적으로 극성을 띠며, 극성을 띠지 않으면 소수성이라 한다.
세포막을 이루고 있는 인지질이나 세제와 같은 물질은 친수성인 머리 부분(인산기와 같은 산기)과 소수성인 꼬리 부분(탄화수소)을 가지고 있는 것도 있다.
소수성(疏水性, Hydrophobe)
물 분자와 쉽게 결합되지 못하는 성질을 의미한다. 일반적으로 극성을 띠지 않으면 소수성을 띤다. 또한 소수성(양친매성)의 물질은 다른 물질과 섞이지 못하여서 소수성 물질의 위에 표면장력 때문에 동그랗게 방울이 생긴다.