| 우리 몸에 가장 많은 원소 ‘인간은 별의 먼지’라는 말을 한 번쯤 들어보셨을 겁니다. 우리 몸을 이루는 원소들이 우주의 별들이 탄생과 죽음을 반복하며 흩뿌린 먼지로부터 왔음을 강조한 말이죠. 사람의 몸에는 약 60가지 원소가 존재한다고 알려져 있습니다. 그렇다면 그중 가장 많은 원소는 무엇일까요? 우리 몸의 99.5%를 차지하는 6가지 원소 우리 몸속 60여 가지의 원소는 각각 다른 비율로 존재합니다. 어떤 원소의 비율이 특히 높은지에 대한 답은 우리가 평소 섭취하는 음식에서 실마리를 찾을 수 있습니다. 우리가 매일 가장 많이 섭취하며 사람의 몸에서도 가장 많은 부분을 차지하고 있는 물질은 물(H2O)입니다. 따라서 수소(H)와 산소(O)가 우리 몸에서 가장 많은 개수를 차지하고 있는 원소인 셈입니다. 그 다음으로 많이 존재하는 원소는 우리가 섭취하는 3대 영양소인 단백질, 탄수화물, 지방의 구성 원소로 유추해 볼 수 있습니다. 단백질의 뼈대를 이루는 아미노산은 탄소(C), 수소, 산소, 질소(N), 황(S)으로 이뤄져 있습니다. 탄수화물과 지방은 탄소, 수소, 산소로 구성돼 있고요. 여기에 공통으로 포함된 탄소도 주요 원소 중 하나임을 예상할 수 있습니다. 실제로 3대 원소(수소, 산소, 탄소)의 원자 개수는 우리 몸 전체 원자 개수의 약 98%를 차지합니다. 3대 원소 중에서도 원자 개수가 가장 많은 것은 수소입니다. 물 분자 한 개당 두 개의 원자가 존재하기 때문입니다. 수소는 몸 전체 원자 개수의 약 62%를 차지하고, 산소와 탄소가 각각 24%와 12%를 차지하고 있습니다. 하지만 이 3대 원소가 우리 몸에서 차지하는 무게 순위는 조금 다릅니다. 각 원소의 원자량이 다르기 때문입니다. 3대 원소의 무게는 몸 전체 무게의 약 93%를 차지하는데, 이중 가장 원자량이 큰 산소가 우리 몸 전체 무게의 약 65%를 차지합니다. 그 다음으로 무거운 탄소가 약 18.5%를 차지하고요. 개수로는 우리 몸의 62%를 차지하지만 가장 가벼운 원소인 수소는 몸 전체 무게의 9.5%를 차지하고 있습니다. 정리하면, 우리 몸에서 원자 개수가 가장 많은 원소는 수소, 가장 무게를 많이 차지하는 원소는 산소라 할 수 있겠습니다. 3대 원소 외에도 우리 몸에는 다양한 원소들이 존재합니다. 대표적인 것이 3대 영양소 중 단백질에 포함된 원소인 질소와 황인데요. 두 원소의 존재량은 상당히 다를 수 있습니다. 질소는 단백질을 구성하는 20개의 아미노산 모두에 포함된 반면, 황은 아미노산 중 오직 시스테인(cysteine)과 메티오닌(methionine)에만 포함돼 있기 때문입니다. 질소는 유전정보를 담고 있는 DNA와 유전정보 해석 및 전달을 담당하는 RNA를 구성하는 필수 원소이기도 합니다. 실제로 질소는 우리 몸을 구성하는 원소 중 원자 개수 측면(1.1%)으로나, 무게 측면(3.2%)으로나 네 번째로 존재감이 큰 원소입니다. 질소 다음으로 풍부한 원소는 우리 몸을 지탱하고 있는 골격, 즉 뼈의 대표적인 구성 원소인 칼슘(Ca)입니다. 칼슘은 몸무게의 약 1.5%를 차지하며, 원자 개수로는 약 0.22%를 차지하는, 우리 몸에서 다섯 번째로 풍부한 원소입니다. 뼈에는 칼슘만 존재하는 것이 아닙니다. 물을 제외한 뼈의 약 30%는 콜라겐 단백질 및 유기물이며, 약 70%가 뼈 미네랄입니다. 뼈 미네랄의 대부분은 수산화인회석(Hydroxyapatite)의 변형된 형태로, 수산화인회석에는 수소와 산소 외에 칼슘과 인(P이 약 1.4~1.7대 1의 비율로 존재하고 있습니다. 따라서 인 역시 우리 몸에 굉장히 풍부할 것으로 예상할 수 있습니다. 인은 질소처럼 DNA와 RNA를 구성하는 주요 원소이기도 합니다. 그리고 단백질이 체내에서 제 기능을 하려면 ‘번역 후 변형(post-translational modification)’이라는 과정을 거쳐야 하는데, 이 과정 중 하나인 인산화에 기여하는 원소죠. 체내 에너지 전달에 중요한 역할을 담당하는 ATP(Adenosine triphosphate)에도 인이 포함돼 있습니다. 인은 우리 몸을 구성하는 원소 중 원자 개수 측면(0.22%)이나, 무게 측면(1.0%)에서 여섯 번째로 풍부한 원소입니다. 다시 정리하면, 산소, 수소, 탄소, 칼슘, 질소, 인 등 6대 원소가 우리 몸무게의 약 99%를 차지하고, 이는 우리 몸을 구성하는 전체 원자 개수의 약 99.5%에 해당하는 양입니다. 무게로만 보면 6대 원소 이외에 비교적 풍부한 원소들은 포타슘(K, 0.4%), 황(S, 0.3%), 소듐(Na, 0.2%), 염소(Cl, 0.2%), 마그네슘(Mg, 0.2%) 등이 있습니다. 특히 포타슘과 소듐은 몸의 이온 항상성을 유지하는 데 필수적인 원소입니다. 세포 내 이들의 농도는 ‘소듐-포타슘 펌프’라 불리는 소듐-포타슘-ATP가수분해효소 막 단백질에 의해 조절됩니다. 황은 수용성 비타민인 티아민(thiamine·비타민 B1)과 바이오틴(biotin·비타민 B7)을 구성하는 원소입니다. 염소는 우리가 매일 섭취하는 소금의 주성분이며, 위액을 구성하는 주요 원소입니다. 염소는 몸속에서 음이온으로 존재해 삼투압 및 수분 평형을 유지하는 데 중요한 역할도 하고 있습니다. 마그네슘은 칼슘, 인과 함께 뼈 미네랄의 주요 성분 중 하나입니다. 우리 몸에는 총 몇 개의 원자가 있을까 이렇게 다양한 원소로 이뤄진 우리 몸에는 모두 몇 개의 원자가 존재할까요? 이 질문에 정확한 답을 하려면 인체에 존재하는 모든 원소들의 원자 개수를 더해야 합니다. 불가능한 일이죠. 하지만 문제를 단순화해 근접한 답을 찾아 볼 수는 있습니다. 가령 몸무게가 72 kg인 성인이 우리 몸에서 압도적으로 많은 양을 차지하고 있는 물(H2O)로만 이뤄져 있다고 가정해봅시다. 물분자 1몰(mol), 즉 약 6×1023개에 해당하는 질량은 18 g입니다. 다시 말해 72 kg인 사람이 물로만 이뤄져 있다면 4000몰, 즉 2.4×1027개의 물 분자가 존재하는 셈이며, 물 분자 한 개는 수소 2개, 산소 1개 등 총 3개의 원자로 이뤄져 있으므로 총 1만2000몰, 즉 7.2×1027개의 원자가 존재하는 셈이 됩니다. 주요 원소들의 인체 내 존재 비율을 고려해 좀 더 복잡한 계산을 하더라도 물로만 계산을 했을 때와 결과는 크게 달라지지 않습니다. 질소(N) 동물의 몸을 구성하는 아미노산의 핵심 원소. DNA, RNA를 구성하는 주요 원소이기도 하다. 수소, 산소, 탄소에 이어 우리 몸에서 네 번째로 존재감이 크다. 표준 상태에서 질소는 원소 두 개가 삼중결합으로 강하게 연결된 기체 분자다. 지구 대기에서 가장 많은 비중(약 78%)을 차지한다. 공기 중의 질소가 생물권과 유기화합물로 이동하고, 다시 대기 중으로 배출되는 순환 과정은 지구 생태계 유지에 매우 중요한 역할을 한다. |
인체의 화학적 구성, 수소(63%), 산소(26%), 탄소(9%), 질소(1%), 원자 개수 가장 많은 원소 수소, 무게는 산소 , 인간은 별의 먼지
탄소, 수소, 산소, 질소 등 4대 원소의 조합(99.3%)으로 이루어진 인체
원자와 분자는 세포구조와 기능의 화학적 단위다. 이 장에서 우리는 인체내의 주된 화학물질의 두드러진 특징들에 대해 설명한다.
1. 원자
모든 화학물질을 구성하는 물체의 단위를 원자atom이라고 한다. 탄소(C), 수소(H), 산소(O), 질소(N)등과 같은 원자 각각의 유형을 화학원소라고 한다. 1개나 2개의 문자부호가 각각의 원소의 약자로 사용된다. 세상에는 약 100개가 넘는 원소가 존재하지만 단지 24개만이 인체의 구조와 기능을 위해 필수적이라고 알려져 있다.

주요원소 4가지 : 수소(63%), 산소(26%), 탄소(9%), 질소(1%) = 체내 전체원자의 99.3%
무기질 원소 7가지 : 칼슘, 인, 칼륨, 황, 나트륨, 염소, 마그네슘 = 체내 전체원자의 0.7%
나머지 미량원소 13가지 : 철, 요오드, 구리, 아연, 망간, 코발트, 크롬, 셀레늄, 몰리브덴, 불소, 주석, 실리콘, 바나듐

다른 자료는... 산소가 65%..


원자의 구성요소
원자의 화학적인 특성은 세가지 원자내의 입자인 양성자(proton), 중성자(neutron), 전자(electron)이라는 용어로 설명할 수 있다. 양성자와 중성자는 원자 중심 즉 원자핵(atomic nucleus)의 아주 작은 부피에 국한되어 있다. 전자는 핵으로부터 다양한 거리에 있는 궤도(orbital)을 따라 회전한다. 각각의 궤도는 2개의 전자만 붙잡을 수 있고 더이상은 불가능하다. 원자가 보다 커지면 더 많은 전자를 가지므로 핵 주위에 더 많은 궤도가 있게 된다. 원자가 점점 더 커짐에 따라 핵으로부터 더 먼거리에 있는 에너지 껍질에서 궤도를 볼 수 있다. 다른 껍질에 있는 전자들은 다른 에너지 양을 지닌다는 관찰로부터 껍질의 이름이 유래되었다. 탄소와 같은 원자는 하나의 전자를 지닌 수소보다 더 많은 에너지 껍질을 지니지만 보다 많은 전자를 지닌 철과 같은 원자보다는 훨씬 적은 것을 가진다.
어떤 원자에서도 첫번째 가장 안쪽의 껍질은 하나의 구형(S) 궤도에 의해 2개의 전자를 붙들 수 있다. 일단 가장 안쪽의 껍질이 채워지면 전자는 두번째 껍질을 채우기 시작한다. 두번째 껍질은 8개의 전자를 붙잡을 수 있는데, 처음 2개의 전자가 S궤도를 채우고 나머지 전자들은 3개의 부가적인 프로펠러 모양(P)궤도를 채운다. 추가 에너지 껍질이 그 이상의 궤도를 수용할 수 있는데, 이는 안쪽의 껍질들이 먼저 모두 채워진 다음에에 일어날 수 있다.

가장 바깥쪽에 있는 에너지 껍질에 있는 모든 궤도가 각각 2개의 전자로 채워져 있을때에 원자는 가장 안정적이다. 만약 하나 또는그 이상의 궤도가 전자를 수용하지 못하였다면, 뒤에 설명하겠지만 원자는 다른 원자와 반응해 분자를 구성하게 된다. 생리학에서 가장 중요한 많은 원자들이 바깥쪽 껍질의 수용량을 채우기 위해 8개의 전자를 필요로 한다.
각각의 아원자 입자들은 서로 다른 전기적 전하를 가지고 있다. 양성자는 하나의 양전하를 가지고 있고, 전자는 하나의 음전하를 가지고 있고, 중성자는 전기적으로 중성이다. 양성자는 원자핵 안에 위치하고 있기 때문에 핵은 그것이 가지는 양성자의 수와 같은 전하를 가진다. 반대되는 전기적 전하는 서로 잡아당기고 같은쪽 전하는 서로 반발한다. 양전하의 양성자와 음전하의 전자사이의 인력이 원자를 구성하는 주요 힘이 된다. 그러나 원자 전체는 전기적 전하를 가지지 않는다. 왜냐하면 핵 주위를 도은 음전하를 띤전자의 수가 핵 안에 양전하를 띤 양성자와 그 수가 같기 때문이다.
원자번호
각각의 화학원소는 특정한 수의 양성자를 가지고 있으며, 그리고 그 숫자가 하나의 원자를 다른 것과 구별되게 하는데 이를 원자번호 atomic number라 한다. 예를들어 가장 간단한 원자인 수소는 그것이 가지는 하나의 양성자에 상응하는 원자번호 1을 가진다. 칼슘은 20개의 양성자에 상응하는 원자번호 20을 가진다. 원자는 전기적으로 중성이기 때문에 원자번호는 또한 원자안의 전자의 수와 동일하다.


원자량
원자는 아주 작은 질량을 가진다. 예를들면 수소원자는 단지 1.67*10에 마이너스 24g의 질량을 가진다. 원자량의 크기는 다른 원자의 질량에 대해 상대적인 원자의 질량으로 나타낸다. 그 척도는 탄소원자의 질량을 12로 한 것에 기초한다. 이러한 척도를 바탕으로 수소원자는 탄소원자의 질량의 1/12을 가지는 대략 1의 원자량을 가진다. 마그네슘원자는 24의 원자량을 가지는데, 이는 탄소원자 2배의 질량이다.
이온
이미 설명한 바와 같이 동일한 수의 음전하를 띠는 전자와 양전하를 띠는 양성자를 가지기 때문에 하나의 원자는 전기적으로 중성이다. 그러나 만약에 원자가 1개나 그 이상의 전자를 얻거나 잃는다면 순 전하를 가지게 되어 이온 ion이 된다. 이는 원자의 바깥쪽 에너지 껍질에 오직 하나 또는 약간의 전자를 가지고 있을 경우에 일어난다. 이런 전자를 잃어버린다는 것은 바로 전의 안쪽 에너지 껍질이 이제는 가장 바깥쪽의 껍질이 된다는 것을 의미한다. 이 껍질은 전자가 모두 채워져 완전한 것이고 그러므로 매우 안정적이다. 안쪽의 에너지 껍질은 전자를 받는 것을 시작하지 않는다는 것을 상기하라.
예를들어 11개의 전자를 가지고 있는 나트륨 원자(Na)가 하나의 전자(-)를 잃는다면 순 양전하를 띤 나트륨 이온(Na+)이 된다. 여전히 11개의 양성자를 가지고 있지만, 이제는 10개의 전자만을 가진다. 2개는 첫번째 에너지 껍질에 그리고 8개 전체를 두번째 바깥껍질에 채우게 된다.
반면에 17개의 전자를 가진 염소원자(Cl)는 바깥껍질을 전부 채우는데, 1개의 전자가 부족하다. 그래서 하나의 전자를 얻어서 순 음전하를 띤 염소이온(Cl-)이 된다. 그래서 이제는 18개의 전자를 가지지만 17개뿐인 양성자를 가진 것이 된다. 몇몇 원자들은 하나 이상의 전자를 얻거나 잃어서 2개 혹은 3개의 순전하를 띠는 이온이 되기도 한다(예, 칼슘이온 Ca2+).

수소와 기타 많은 원자들은 쉽게 이온을 형성한다. 표 2-2는 신체에서 보이는 몇몇 원소들의 이온형태를 나타낸 것이다. 순 양전하를 띤 이온은 양이온(cation)이라고 한다. 이들이 지닌 전하때문에 이온들은 물에 용해되었을때 전기를 전도할 수 있다. 따라서 무기질 원소의 이온형태를 총괄하여 전해질(electrolyte)이라고 한다.
신체의 원자 구성
신체의 단지 4개의 필수원소 수소, 산소, 탄소, 질소가 신체내 원자의 99.3%를 차지한다. 7개의 필수 무기질 원소들은 세포내외 용액에 녹아 있는 가장 많은 물질이다. 그러나 대부분 몸의 칼슘과 인 원자는 뼈조직의 고형기질을 만든다. 13개의 필수 미량원소(trace element)는 극단적으로 아주 적은 양이 존재하지만, 그럼에도 불구하고 그들은 정상적인 성장과 기능에 필수적이다. 예를들면, 철은 혈액에 의한 산소의 수송에 있어서 결정적인 역할을 한다.
2. 분자(molecule)
함께 결합된 2개나 그 이상의 원자들은 분자를 형성한다. 2개 혹은 그 이상의 다른 원소들로 만들어진 분자를 화합물이라고 한다.
공유화학결합
하나의 분자안에서 원자들 사이의 화학결합은 전자들이 한원자의 바깥쪽 에너지 껍질로부터 다른 원자의 껍질로 전자가 전달될때 혹은 부분적으로 채워지지 않은 전자궤도를 지닌 2개의 원자가 전자를 공유할때 형성됨. 재개의 원자 사이에서 가장 강한 화학결합을 공유결합이라고 하는데, 각원자의 바깥 전자궤도에 있는 하나 또는 그 이상의 전자들이 2개의 원자사이에서 공유할때 형성됨.

그림에서 보는 바와같이 첫번째 전자껍질에 2개의 전자 그리고 바깥쪽 껍질에 4개의 전자를 지닌 탄소가 4개의 수소원자와 공유결합을 형성함. 원자의 두번째 에너지 껍질에는 8개의 전자를 갖고 있을 수 있다는 사실을 상기하라. 탄소는 모두 6개의 전자를 갖고있는데, 첫번째 에너지 껍질을 채우는데는 2개의 전자를 사용하였기 때문에 두번째 껍질에는 오직 4개만을 갖고 있음. 그러므로 바깥쪽 껍질에 4개의 전자를 더 채울 수 있는 여유가 있음. 수소는 단 하나의 전자를 지니고 있고 모든 궤도와 마찬가지로 수소 1개의 에너지 궤도로 2개의 전자까지 채울 수 있음. 그러므로 수소도 또한 1개의 전자를 더 채울 수 있는 공간이 있음. 이 예에서 1개의 탄소원자는 다른 4개의 수소원자들과 4개의 전자를 공유하고 마찬가지로 수소원자들은 탄소원자와 그들의 전자를 공유함. 공유한 전자들은 양 원자 주위를 궤도를 그리며 돌면서 서로 결합하여 메탄(CH4)분자가 됨. 이들 공유결합은 신체에서 가장 강력한 결합으로 한번 형성되면 일반적으로 열과 같은 에너지원이나 효소로 처리하지 않는 한 서로 분리되지 않음.
이미 언급한 바와같이 몇몇 원소의 원자들은 하나 이상의 공유결합을 형성할 수 있어서 2개나 그 이상의 다른 원자들과 동시에 결합되어 있음. 각 종류의 원자는 가장 바깥쪽 궤도의 전자수에 의존하는 특정 수의 공유결합을 형성함. 신체 내에서 가장 많은 네가지 원자에 의해 형성되는 화학결합의 수는 수소는 1개, 산소는 2개, 질소는 3개, 탄소는 4개임.
분자의 구조를 나타낼때 각각의 공유결합은 공유된 전자의 쌍을 선으로 나타냄. 방금 언급한 네가지 원소의 공유결합들은 다음과 같이 나타남.
H - O - N - C...
물분자 H20는 다음과 같이 나타냄. H-O-H
경우에 따라서 2개의 공유결합-이중결합-이 각각의 원자로부터 2개의 전자를 공유함으로서 2개의 원자 사이에서 형성됨. 이산화탄소는(CO2)는 2개의 이중결합을 가짐
O=C=O
이 분자에서 탄소원자가 여전히 4개의 공유결합을 형성하고, 각각의 산소원자는 오직 2개씩을 형성함에 유념하여야 함.
물분자 H2O
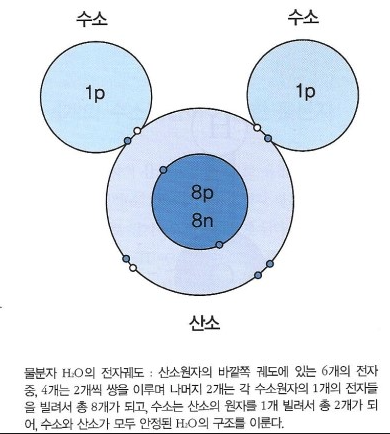
1) 극성 공유결합
모든 원자가 공유하는 전자를 잡아당기는 능력이 동일한 것은 아니다. 공유결합에서 원자가 전자를 잡아당기는 능력의 척도를 전기음성도(Electronegativity)라 한다. 전기음성도는 일반적으로 핵의 총체적인 양성 전하가 증가하면 증가하는 반면에 공유하는 전자와 핵 사이의 거리가 증가하면 감소한다. 서로 다른 전기음성도를 가진 2개의 원자가 결합하여 공유결합을 형성할때 공유한 전자는 보다 높은 전기음성도를 지닌 원자의 궤도를 돌면서 더 많은 시간을 소비하는 경향을 갖게 된다. 이것이 결합을 가로지르는 극성을 만든다.
설명한 바와 같이 전자 분포에서 극성에 의해 보다 많은 전기음성도를 지닌 원자는 약간의 음전하를 갖게되고 반면에 상대원자는 부분적으로 전자를 잃어 약간의 양전하를 띠게 된다. 이런 결합을 극성 공유결합(polar covalent bond)이라고 하는데, 결합의 말단에 있는 원자들이 반대의 전하를 지니게 되기 때문이다.
예를들어 수산기(hydroxyl group - OH)에서 수소와 산소사이의 결합은 극성 공유결합으로 산소는 약한 음전하를 수소는 약한 양전하를 띤다. ..
참고) 카르복실기
카복시기(Carboxyl group)는 탄소, 산소, 수소로 이루어진 작용기의 하나로, -COOH 또는 -CO2H 로 표시된다. 카복시기는 아미노산이나 카복실산에 존재한다. 카복시기의 구조는 우측의 그림에서처럼 중심의 탄소 원자에 하나의 산소 원자가 이중 결합으로 연결되어 있고, 하나의 하이드록시기가 단일 결합으로 연결되어 있다. 분자식에 비추어보면, 카복시기는 -C=O- 의 형태의 카보닐기에 하이드록시기가 붙어있는 형태이다.
카복시기는 중심 탄소 원자에 하나의 최외각 전자를 지니고 있기 때문에, 보다 큰 분자와 결합할 수 있다. 하지만, 기본적으로 3 개의 결합을 필요로 하는 카복시기는 탄소 사슬의 끝부분에만 위치할 수 있다. 카복시기는 아세트산이 수소 이온을 방출해서 아세테이트가 되는 것처럼 수소 이온(H+)을 내놓아 산으로 작용할 수 있다
전자에 대해 상대적으로 강한 인력을 가지는 산소, 질소, 그리고 황원자는 수소원자와 극성결합을 형성함. 아래표. 생리학을 이해하는데 중요한 극성 결합의 특징 중 하나는 극성결합을 하는 분자는 다음에 설명할 주된 공유결합의 형태를 지닌 분자들보다 물에 더 잘 녹는 경향을 갖는다. 그 결과 이런 분자들을 소위 극성분자(polar molecule)라 하고 혈액, 세포간 용액, 세포내액에 쉽게 녹는다. 그뿐 아니라 물 자체는 부분적으로 음전하를 지닌 1개의 산소원자와 부분적으로 양전하를 지닌 2개의 수소원자로 이루어진 전형적인 극성분자의 예가 된다.

2) 비극성 공유결합
극성 공유결합과는 대조적으로 비슷한 전기음성도를 지닌 원자들 사이의 결합을 비극성 공유결합(nonpolar covalent bond)이라 한다. 이런 결합에서 전자는 두 원자에 의해 동일하거나 거의 동일하게 나누며 결합전반에 걸쳐 전하의 분포가 동일하거나 거의 동일하다. 탄소와 수소원자 사이, 그리고 2개의 탄소원자 사이의 결합은 전기적으로 중성이고 비극성 공유결합이다. 비극성 공유결합을 상당량 지니고 있는 분자를 비극성 분자(nonpolar molecule)라 하며 이들은 극성 공유결합의 경우보다 물에 덜 녹는 경향이 있다. 그 결과로 이런 분자는 종종 세포막의 지질 이중층이나 세포내 소기관에서 볼 수 있다. 혈액과 같은 체액에 존재할때 이들은 비극성 분자가 용액으로부터 빠져나가는 것을 방지하기 위해 일종의 "운반체"와 같이 작용하는 극성분자와 연결되기도 한다.
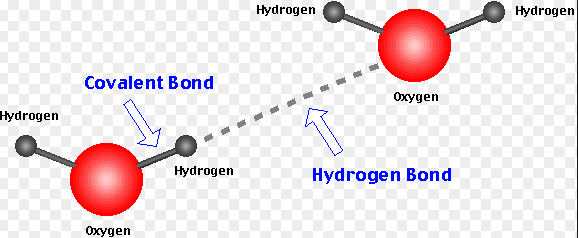
수소결합(hydrogen bond)
극성분자 2개가 서로 가깝게 접해 있을때 이들 사이에 전기적 인력이 생길 수 있다. 예를들면 하나의 분자에서 극성결합을 하고 있는 수소원자와 그리고 다른 분자에서 극성 결합을 하고 있는 산소나 질소원자는 서로 잡아당겨 수소결합이라 불리는 결합의 형태를 이룬다. 이런 결합은 동일분자내의 원자들 사이에서 생길수도 있다. 수소 결합은 공유결합과 구별하기 위해 점선으로 표시한다. 물 1개 분자에서 수소와 산소원자 사이의 극성결합 강도의 오직 약 4%정도에 불과할 정도로 수소결합은 약하다. 수소 결합은 개별적으로는 약하지만 많은 수로 존재할 경우 이들 분자 상호작용과 커다란 분자의 모양을 결정하는데 매우 중요한 역할을 한다. 거대 분자들의 모양은 흔히 그들의 기능과 다른 분자들과 상호작용을 하는 능력을 결정하기 때문에 생리학적 입장에서는 매우 중요하다. 한 예로서 어떤 분자는 양쪽 분자가 정확하게 맞는 구조를 갖추고 있을때에만 열쇠와 자물쇠 구조로서 서로 작용한다.

분자모양
원자들이 서로 연결될때 다양한 모양의 분자들이 형성될 수 있다. 이 분자구조는 3차원적인 것임을 잊지 말아야 한다. 주어진 원자주위에 대칭적이거나 그렇지 않은 형태로 분포한다. 분자들은 단단하지 않고 유연한 구조이다. 어떤 범위안에서 분자의 모양은 원자를 함께 연결하는 공유결합을 깨뜨리지 않고도 변화할 수 있다. 공유결합은 결합된 원자들이 주위를 회전할 수 있는 축과 같다. 앞으로 계속되는 장에서 보겠지만 3차원적인 분자의 유연한 모양은 분자간의 상호작용을 지배하는 주요한 요인 중의 하나이다.


이온분자
이온화라고 하는 이온형성과정은 하나의 원자에서 또는 분자에서 공유결합으로 연결되어 있는 원자에서 일어날 수 있다. 분자내에서 흔히 볼수 있는 이온화되는 2개의 원자집단은 카르복실기(COOH)와 아미노기(NH2)이다. 오직 한분자의 한 부분만을 나타낼때 간단한 구조식으로써 R-COOH나 R-NH2처럼 적을 수 있다. 카르복실기는 수소와 연결된 산소가 수소의 전자 1개를 획득해서 카르복실 이온(R-COO-)을 형성하고 수소이온(H+)을 내보낼때 이온화된다.
R-COOH <--> R-COO-+H+
아미노기는 수소이온과 결합하여 이온화된 아미노기(R-NH3+)를 형성할 수 있다.
R-NH2+H <---> R-NH3+
이러한 각각의 기들의 이온화는 이중 화살표로 나타난 것과 같이 가역적이다. 이온화된 카르복실기는 수소이온과 결합하여 이온화되지 않은 카르복실기를 형성할 수 있다. 그리고 이온화된 아미노기는 수소이온을 잃어서 이온화되지 않은 아미노기가 될 수 있다.
자유라디칼(free radical)
앞에서 설명한 바와 같이 원자의 핵 주위를 회전하는 원자는 에너지 껍질들을 차지하는데, 이들 각각은 하나 또는 그 이상의 궤도로 되어있고 각기 2개의 전자까지 지닐 수 있다. 원자는 바깥쪽 껍질에 있는 각 궤도가 전자로 충족되게 채워질때 가장 안정하다. 바깥쪽 껍질에 있는 하나의 궤도내에 하나의(짝지어 있지 않은) 전자를 지닌 원자를 자유라디칼(free radical)이라고 하며, 이러한 원자를 포함한 분자도 마찬가지다. 자유라디칼은 산화과정을 통해 다른 원자와 반응할 수 있는 불안정한 분자이다. 자유라디칼이 다른 원자를 산화시킬 때 자유라디칼은 전자를 얻고 상대원자는 보통 새로운 자유라디칼이 된다.
자유라디칼은 병원체를 파괴하는 백혈구와 같은 일부 세포에 있는 특정한 효소들의 작용에 의해 형성된다. 자유 라디칼은 반응성이 매우 높아서 이를테면 병원체의 세포막에 있는 분자들 내의 원자의 바깥쪽 껍질로부터 전자를 제거한다. 이 메커니즘에 의해서 병원체가 파괴되는 과정이 시작된다.
또한 자유라디칼은 방사선이나 독성물질을 섭취하였을때 몸속에서도 생길 수 있다. 이들 자유라디칼은 신체의 세포에 상당한 해를 입힐 수 있다. 예를들면 오랜 기간 자유라디칼이 쌓여 생기는 산화는 여러가지 다른 사람의 질병, 그 중에서도 특히 눈, 심혈관 그리고 노와와 관련된 신경성 질환 원인의 하나로 여겨져 왔다. 그러므로 자신은 위험한 자유라디칼이 되지 않으면서 자유라디칼에 전자를 공여할 수 있는 분자들에 의해서 자유라디칼이 불활성화되게 하는 것이 중요하다. 이와 같은 보호분자들의 예로 항산화성 비타민 C와 E가 있다. 자유라디칼은 원자 기호 옆에 있는 점으로 표시한다. 생물학적으로 중요한 자유라디칼의 예는 과산화물 음이온 O2.-, 수산기 라디칼 OH. 산화질소 NO. 이다. 자유라디칼 형태가 이온화(전하를 띤)되거나 이온화되지 않은 분자 둘 다에서 생길수 있다는 것을 주목하라.
3. 용액(Solution)
액체에 녹는 물질을 용질(solute)
용질을 녹인 액체를 용매(solvent)
용질은 용매에서 녹아 용액(solution)을 형성
물은 전체 체중의 60%를 차지하는 몸에서 가장 많은 용매이다. 체내에서 일어나는 화학반응의 대부분은 세포내 용액이든, 세포외 용액이든 물에 녹아 있는 분자들이 관여한다. 그러나 모든 분자들이 물에 녹는 것은 아니다.
물
물은 신체내에서 가장 흔한 분자이다. 100개 분자중 99개가 물이다. 물 분자에서 2개의 수소원자를 산소원자에 연결한 공유결합은 극성이다. 그러므로 물에서 산소는 부분 음전하를 띠며 각 수소는 부분 양전하를 띤다. 한 물 분자의 수소원자 인근의 양성 극성부위는 인접한 물 분자의 산소원자의 음성 극성부위를 전기적으로 끌어당겨 수소결합을 이룬다.
0도와 100도 사이의 온도에서 물은 액체로 존재하고, 이 상태에서 물분자 사이에 약한 수소결합이 생겼다가 파괴되는 것을 계속하다가 때때로 어떤 물분자는 액체상태를벗어나 기체가 된다. 만약에 온도가 계속 올라간다면 수소결합은 더 쉽게 파괴되어 물분자는 기체상태로 빠져나간다. 그러나 만약 온도가 계속 낮아진다면 수소결합은 덜 파괴될 것이며 0도가 될때까지 물분자는 계속해서커진 얼음덩어리가 되었다가 물이 얼면 고형의 결정성 기질인 얼음이 된다. 사람의 정상체온은 37도에 가까우므로 물은 체내에서 액체형태로 존재한다. 그럼에도 불구하고 심지어 이 온도에서도 어떤 물은 기체로 몸에서 빠져나가는데 호흡시 숨을 쉴대마다 수증기로 빠져나간다. 이런 수증기의 형태로의 물 손실은 총 신체-물의 항상성을 위해 상당히 고려할 만한 중요성을 가지고 있으므로 음식이나 음료를 통해 얻어지는 물과 대체되어야만 한다.
물분자는 일반적인 형태의 많은 화학반응에 참여한다.
R1-R2 + H-O-H <---> R1-OH+H-R2
이 반응에서 R1과 R2사이의 공유결합과 물에서의 수소가 산소 사이의 공유결합은 깨지며 수산기와 수소이온은 각각 R1과 R2로 이동하게 된다. 이러한 형태의 반응을 가수분해라고 한다. 체내의 많은 큰 분자들은 가수분해에 의해서 보다 더 작은 분자단위로 분해되며 보통 효소라고 하는 분자의 도움을 받는다. 이 반응은 보통 가역적이고 축합 또는 탈수라는 과정이다. 탈수에서 2개의 작은 분자를 1개의 커다란 분자로 결합시키기 위해 물 한분자를 온전히 제거한다. 탈수반응은 신체가 필요로하는 단백질이나 기타 고분자 물질을 만드는데 있어서 중요하다.
생리학에서 중요한 물의 다른 성질로서는 물에 녹아 있는 물질인 용질의 수에 의존하는 총괄성의 성질이 있다. 예를들면 제 4장에서 자세히 배우게 될 삼투과정에 의해 물이 용액의 구획사이를 움직인다. 삼투에서 물은 용질의 농도가 낮은 곳에서 용질의 농도가 높은 곳으로 용질의 종류에 상관없이 움직인다.
체내의 대부분 화학반응은 수용액에서 분자들 사이에서 일어난다는 것을 명심하라. 그러므로 서로 다른 분자들의 상대적인 용해도는 화학반응에 참여하는 능력에 영향을 준다.
분자의 용해도
물에 용해되기 위해서 물질은 전기적으로 물분자에 끌어당겨져야 한다. 예를들면, 소금 NaCl은 양성 나트륨 이온과 음성 염소이온사이에 강한 전기적인 인력으로 인한 고체결정 물질이다. 2개의 반대로 하전된 이온사이의 이러한 강한 인력을 이온결합이라고 한다. 염화나트륨의 결정이 물에 들어가면 극성인 물분자는 하전된 나트륨과 염소이온에 끌어당겨지게 된다. 이온은 물분자의 무리에 둘러싸이게 되면서 나트륨과 염소이온이 소금결정으로부터 분리되어 물에 들어가 용해된다.

다수의 극성 결합이나 이온화된 집단을 가진 분자들은 물에 용해된다. 이러한 분자들을 친수성(hydorphilic)즉 물을 좋아하는 분자라고 한다. 그러므로 카르복실기나 아미노기와 같은 이온화된 집단이나 분자내의 수산기와 같은 극성집단의 존재는 물에서의 용해도를 증진시킨다. 반대로 주로 탄소나 수소로 구성된 분자들은 물에서 불용성인데 그 이유는 이들의 전기적으로 중성인 공유결합들은 물분자를 끌어당기지 못하기 때문이다. 이러한 분자들은 소수성(hydrophobic) 즉 물을 싫어하는 분자들이다.
소수성 분자들이 물과 함께 섞여 있을때 기름이 물과 섞일때 나타나는 것처럼 2개의 상이 형성된다. 극성 분자들 사이의 강한 인력은 물의 상에서부터 비극성 분자들을 밀어 짜낸다. 그러나 이러한 분리가 100% 완벽한 것은 아니고 아주 약간의 비극성 용질이 물의 상안에 용해된 채로 남아 있다.
참고) 양친매성(amphipathic) - 양쪽을 사랑하는 분자..
참고) 몰(1mol/L)
몰(mole, 기호: ㏖)은 물질의 입자의 수를 나타내는 국제단위계의 기본 단위이며, 화학에서 많이 쓰이는 단위이기도 하다. 통상적으로 '입자'란 분자로 이루어진 물질의 경우 분자, 혹은 결정 따위의 경우 실험식의 단위 따위를 일컬으며, 때로는 전자, 광자 등의 수를 나타내기도 한다. 거시적 계의 입자수는 직접적으로 측정하기 어렵고, 또 측정하더라도 너무 크기 때문에, 편의상 몰이라는 새로운 측정량을 도입하였다. 1몰은 탄소-12 12 g의 원자의 수로 정의한다. 1몰에 해당하는 입자의 수는 아보가드로 수라고 부르며, 약 6.0221415×1023이다. 용액의 농도를 몰 수를 이용하여 표시할 수 있는데, 몰랄 농도는 용매 1 kg 속에 들어 있는 용질의 몰 수이며, 몰 농도는 용액 1 l 속에 들어 있는 용질의 몰 수이다
농도
용질농도는 용액의 한 단위 부피안에 존재하는 용질의 양으로써 정의한다. .. 분자의 분자량은 분자내의 모든 원자들의 원자량의 합과 동일하다. 예를들면 포도당(C6H12O6)은 180분자량을 가진다. 화합물 1몰은 분자량과 같은 그램 수에 해당하는 화합물의 양이다. 용액 1L안에 180g의 포도당(1몰)을 포함한 용액은 포도당의 1몰 용액이다. 만약에 포도당 90g이 1리터의 물에 용해되어있다면, 이 용액은 0.5 mol/L의 농도를 가질 것이다. 어떤 원소의 1분자 1몰(1그램 분자량) 원자 질량이 같은 수의 원자를 가지는 것처럼, 어떤 분자 1몰은 6*10 23승(아보가드로 수)의 분자를 가진다. ....
체액의 수용성 용액에서 분자들의 농도는 화학반응의 중요한 결정인자이다. .. 만약 혈액내의 Ca2+ 농도가 어떤 이유로 낮아진다면 이것이 계기가 되어 뼈에 저장되어 있던 Ca2+의 일부를 혈액으로 내보내도록 자극하는 호르몬이 혈액내로 방출되어 결국 혈액의 Ca2+수준이 정상으로 회복되게된다.
또 다른 항상성 변수와 관련된 용질 농도의 중요성과 관련된 두번째 예로 다음에 설명할 pH가 있다. 체액에서 pH(즉 수소이온 농도)도 좁은 범위내에서 유지되는 것이 대부분의 생리적 과정에서 아주 결정적인데 부분적으로는 단백질과 효소들이 정상적인 모양과 활동을 하기 위해 pH에 의존적이기 때문이다.
수소이온과 산성도
수소원자는 하나의 전자가 궤도를 이루는 핵안에 하나의 양성자를 가지고 있다. 수소이온(H+)의 가장 일반적인 형태는 전자의 손실에 의해 형성되므로 하나의 자유 양성자이다. 용액에서 양성자(수소이온)을 내보내는 분자를 산(acid)라고 한다.
예를들면
HCL(염산) -> H+ + CL-(염소이온)
H2CO3(탄산) <--> H+ + HCO3-(중탄산염)
역으로 수소이온(양성자)를 받아들일 수 있는 어떤 물질은 염기(base)라고 한다.
젖산, 탄산, 전산염, 중탄산염... 강산, 약산,, 산성도.. 수소이온과 결합함으로써 염기는 용액에서 수소이온 농도를 낮춤. 염산을 물에 용해할때, 원자의 100%가 분리되어서 수소와 염소이온이 되며 이러한 이온들은 용액에서 다시 결합하지 않음. 그러나 젖산의 경우에는 용액에서 젖산분자들 중에서 일부만이 어느 순간에도 수소이온을 유리시킴. 그러므로 1mol/L의 젖산 용액과 1mol/L의 염산용액을 비교한다면 수소이온 농도는 염산용액에서보다 젖산용액에서 더 낮을 것임.
용액에서 완전히 또는 거의 완전히 이온화된 염산과 그 밖의 산들은 강산으로 알려져 있는 반면에 용액에서 완전히 이온화되지 않은 탄산이나 젖산 그리고 기타 산들은 약산임. 같은 원리가 염기에도 적용됨.
용액의 수소이온 농도는 용액에서 자유로운 수소이온만을 의미하며, 예를들어 아미노기(R-NH3+)와 같이 결합되어 있는 수소이온은 해당되지 않음을 이해하는 것이 중요함. 용액의 산성도는 용액에서 자유로운 수소이온 농도를 말하며, 수소이온 농도가 높을 수록 산성도는 높음. 수소이온 농도는 종종 밑이 10인 수소이온 농도의 마이너스 대수로써 정의되는 용액 pH로 나타냄.
pH = -log(H+)
그러므로 10 마이너스 7승 몰의 수소이온 농도를 가지는 용액은 pH 7을 가진다. 반면에 더 높은 산성용액인 10 마이너스 6승 몰의 수소이온 농도를 가지는 용액은 보다 낮은 pH6을 가진다. 산성도가 증가하면 pH가 감소한다는 것에 유념하라.
pH 7 은 중성용액
pH 6 은 산성, pH 8은 알카리 용액
생명체는 세포외액에서 pH 범위가 7.35-7.45에 이르는 항상성의 범위를 가지므로 약한 알카리성을 띈다. 대부분의 세포내액은 세포외액보다 수소이온 농도가 약간 더 높다.
4. 유기분자의 종류
자연상태에서 만들어지는 탄소를 포함한 대부분의 분자는 살아있는 생명체에서 발견되기 때문에 이러한 화합물에 대한 학문을 유기화학이라고 한다. 무기화학은 비-탄소 함유분자에 대한 학문이다.
생명을 가능하게 만드는 탄소원자의 성질 중 하나는 다른 원자(탄소원자도 포함)들과 4개의 공유결합을 형성하는 것이다. 탄소원자는 수소, 산소, 질소, 황원자와 결합할 수 있기 때문에 비교적 적은 수의 화학원소로부터 막대한 수의 화합물이 만들어질 수 있다. 이러한 분자들의 어떤 것은 수천개의 원자로 구성되어서 극단적으로 크다. 거대분자(macrmocule). 이러한 큰 분자들은 수많은 분자 또는 소단위들이 서로 연결될때 형성된다. 큰분자들은 중합체(polymer 여러개의 작은 부분)라고 알려져 있다. 거대분자의 구조는 소단위의 구조, 서로 연결된 소단위의 수 그리고 소단위가 연결된 3차원적인 방식에 달려있다.
몸안의 대부분의 유기분자들은 탄수화물, 지질, 단백질과 핵산 4종류들 중의 하나로 분류될 수 있다.

탄수화물 체중의 1%, 주요원자 C, H, O 다당류와 2당류 . 소단위는 단당류
지질 체중의 15% 주요원자 C, H TG, 인지질, 스테로이드, 소단위는 지방산, 글리세롤
단백질 체중의 17%, 주요원자 C, H, O, N 펩티드와 폴리펩티드, 소단위는 아미노산
핵산 체중의 2%, 주요원자 C, H, O, N 염기인 아데닌, 시토신, 구아닌, 티민. 당인 데온시리보오스 ...
1) 탄수화물
탄수화물은 단지 체중의 1%정도를 차지하고 있지만, 세포에 에너지를 공급하는 화학적 반응의 중심적인 역할을 한다. 에너지는 포도당분자에 화학적 결합으로 저장되어 있다가 세포내에서 필요시에 이 에너지가 방출되어 아데노신 3인산(ATP)이란 다른 분자에 결합되어 저장됨. ATP에 결합된 형태로 저장된 에너지는 세포 생존에 필요한 모든 것, 근육의 수축, 단백질 합성 등 체내의 수많은 여러가지 반응에 동력으로 사용됨.
탄수화물은 탄소, 수소, 산소원자가 일반식 C(HO)에 의해 나타내는 비율로 구성되어 있다. 즉 물을 함유하는 탄소라는 의미의 탄수화물이란 분자의 분류이름을 얻었다. 탄수화물에서 대부분의 탄소원자와 결합한 것들은 수소원자와 수산기이다. 많은 수의 수산기의 존재는 탄수화물을 물에 쉽게 용해되게 만든다.

대부분의 탄수화물 특히 당으로 알려진 탄수화물은 단맛이 있다. 가장 단순한 당은 단당류이고, 가장 흔한 것은 포도당인데, 탄소가 6개인 분자(C6H12O6)이다. 포도당은 혈액에서 발견되는 주된 단당류이므로 흔히 혈당이라고 불린다. 단당류의 원자간 결합을 두가지 방식으로 나타내고 그림 2-9에 도식화하였다.

첫번째는 유기분자들의 구조를 그리는 전통적 방식이지만 두번째는 그들의 3차원적 형태를 보다 잘 표현해줌. 5개의 탄소원자와 하나의 산소원자는 본질적으로 편평한 평면에 놓이는 고리를 형성함. 각 탄소의 수소와 수산기는 이 고리의 평면위와 아래에 놓여있음. 고리 아래쪽의 수산기 하나가 고리위로 이동하면 그림에서 보는 것과 같은 단당류가 만들어짐.
몸안에 대부분의 단당류는 5개나 6개의 탄소원자를 함유하는데, 각각 5탄당(pentonse)과 6탄당(Hexose)라고 한다. 보다 더 큰 탄수화물은 다수의 단당류들이 서로 연결되어서 만들어질 수 있다. 2개의 단당류로 구성된 탄수화물을 2당류(disaccharide)라고 한다. 설탕(sucrose)은 2개의 단당류인 포도당과 과당으로 구성된다. 단당류의 상호 연결은 대부분 하나의 단당류로부터 수산기와 다른 것에서 수소원자를 제거해 물 한분자를 발생시키고, 산소원자를 통해 2개의 당이 결합되는 탈수반응을 포함하고 있다. 역으로 2당류의 가수분해는 물을 다시 가해 이 결합을 끊어서 2개의 단당류로 분리되게 한다. 자주 접하게 되는 2당류로는 커다란 탄수화물이 소화관에서 소화되는 과정에서 생기는 맥아당(포도당-포도당)과 우유에 있는 젖당(포도당-갈락토오스)이 있다.

여러개의 단당류가 서로 연결되어 중합체를 형성할때, 다당류(polysaccharide) 라고 알려진 분자들이 된다. 식물세포에서 발견되는 녹말과 동물세포에 존재하고 흔히 "동물성 녹말"이라고 불리는 클리코겐(glycogen)이 다당류의 예이다. 이들 두 종류의 다당류는 모두 수천개의 포도당 분자가 서로 긴 사슬로 연결되어 있으며, 사슬을 따라 가지 친 정도에만 차이가 있을 뿐이다. 클리코겐은 인체에서 이용가능한 에너지 저장고로 존재하는데, 각각의 포도당 단당체 내의 화학결합에 저장되어 있다. 단식기간 동안에 일어나는 클리코겐 가수분해는 포도당 소단위들을 혈액으로 방출해 혈당이 위험하게 낮은 수준으로 감소되는 것을 방지한다.

지질(lipid)
지질은 주로 수소와 탄소원자로 구성된 분자이다. 이들 원자들은 비극성 공유결합에 의해서 연결되어 있다. 그러므로 지질은 비극성이고 물에 용해도가 매우 낮다. 평균하여 신체 유기물질의 약 40%를 차지하고(체중의 15%)있는 지질은 지방산, 트리글리세라이드, 인지질, 스테로이드의 네가지 하위분류군으로 나눌 수 있다. 탄수화물과 같이 일부지질은 유용한 에너지원을 제공하기 때문에 지질은 생리학에서 매우 중요하다. 다른 지질들은 모든 세포막의 주요성분이고 또 다른 것은 신호전달 분자로 중요하다.
1) 지방산(fatty acid)
지방산은 한쪽 말단에 산성인 카르복실기를 가지고 있는 탄소와 수소원자의 사슬로 구성되어 있다. 그런 이유때문에 지방산은 탄소와 수소의 구성요소에 덧붙여 2개의 산소원자를 함유한다. 지방산은 신체의 세포내에서 2개씩으로 된 탄소 분절들이 서로 연결하여 합성되기 때문에, 그 결과 16 혹은 18개의 탄소원자로 된 지방산이 가장 일반적이다. 지방산의 모든 탄소가 단일 공유결합에 의해 연결되어 있을때 그 지방산을 포화지방산(saturaded fatty acid)이라 하는데, 이는 각각의 탄소원자에 남아있는 결합이 가능한 2개가 H로 공유적으로 연결되어 모두 채워져 포화되어 있기 때문이다.
몇몇 지방산은 탄소원자들 간에 1개 혹은 그 이상의 이중결합을 가지기에 이들을 불포화지방산(unsaturaded fatty acid, 이들은 포화지방산보다 C-H 결합을 적게 가지고 있다)이라고 한다. 만약에 하나의 이중결합이 존재하면 그 지방산은 단일 불포화(monounsaturated)된 것이고, 만약에 하나 이상의 이중결합이 존재한다면 이는 다중불포화(polyunsaturated)된 것이다.
자연계에 있는 대부분의 불포화지방산은 이중결합의 탄소의 같은 명에 2개의 수소 모두가 있는 시스위치로 존재한다. 그러나 일부 지방식품을 제조하는 과정에서 이중결합의 반대편에 수소들이 있도록 지방산을 변화시키는 것이 가능하다. 이와 같이 화학적으로 변경시킨 지방산을 트랜스지방산(trans fatty acid)이라 한다. 트랜스 배치는 식품을 장기 보존하는데 안정성을 더해주고 식품의 맛과 일관성을 변화시킨다. 그러나 건강에 문제가 있으므로 주의..
지방산은 체내에서 세포대사에 필요한 에너지를 제공하는 것 이외에도 수많은 중요한 기능을 한다. 지방산에서는 탄소와 수소원자 사이의 결합이 깨지면서 나오는 화학에너지는 ATP의 화학에너지로 저장될 수 있다. 그러므로 포도당과 같이 지방산은 에너지의 중요한 공급원으로 특히 중요하다. 게다가 어떤 지방산은 변형되어 수 많은 세포기능을 조절하는 특별한 분자부류를 만들 수 있다.
5장에서 설명되겠지만 이와같이 변형된 지방산들을 총칭하여 에이코사노이드(eicosanoid)라고 하는데, 탄소가 20개인 다중불포화지방산인 아라키돈산으로부터 유도됨. 마지막으로 지방산은 다음에 기술한 트리글리세리드 구조의 한 부분을 이룸.
2) 트리글리세라이드(Triglyceride)
트리글리세리드는 신체 지질의 대부분을 이루고 있고, 일반적으로 이들은 단순히 지방이라고 불리는 분자들이다. 트리글리세리드는 3탄소 알콜인 글리세롤에 3개의 지방산이 결합하여 형성된다. 글리세롤의 3개의 수산기 각각은 탈수반응에 의해 지방산의 카르복실기와 결합되어 있다.



트리글리세리드 한분자에 있는 3개의 지방산은 일반적으로 같지 않다. 그러므로 사슬의 길이와 포화도가 다른 지방산으로부터 다양한 지방이 형성될 수 있다. 동물지방은 일반적으로 포화지방산의 비율이 높은 반면에, 식물지방은 불포화지방산을 더 많이 함유한다. 포화지방은 낮은 온도에서 고체화되는 경향이 있다. 반면에 불포화지방은 매우 낮은 융점을 가져서, 매우 낮은 온도에서 조차 용액(기름)이다. 예를들어 햄버거를 가열하면 포화된 동물지방이 녹아 프라이팬에 기름기가 남게 된다. 그러나 식히면 유상의 기름기가 다시 고체형태로 돌아간다.
트리글리세리드는 혈액에서 볼 수 있고, 간에서 합성될 수 있다. 이들은 지방조직에 다량으로 저장되어 체내세포에 에너지를 공급하는데, 특히 기아 상태동안이나 운동을 하는데 부차적인 에너지가 필요한 경우에 기여한다. 이는 지방조직에서 일어나며, 유리된 지방산은 혈액으로 들어가 세포기능에 필요한 에너지를 주어 물질대사가 이루어질 수 있도록 조직이나 기관에 운반된다. 그러므로 다당류에서처럼 트리글리세리드의 형태로 에너지를 저장하기 위해서는 탈수반응이 요구되며, 다당류와 트리글리세리드 둘다 사용 가능한 에너지 형태로의 분해는 가수분해에 의해서 이루어진다.

3) 인지질(phospohlipid)
인지질은 구조에 있어서 트리글리세리드와 한가지 중요한 차이를 제외하고 전반적으로 유사하다. 글리세롤의 세번째 수산기가 지방산에 결합되어 있기보다는 인산이 결합되어 있다. 게다가 극성을 띠거나 이온화된 질소를 함유한 조그만 분자가 이 인산에 붙어있다. 이러한 작용기는 인지질의 한쪽 말단에 극성(친수성) 부위를 구성하고, 반면에 지방산 사슬은 반대편 말단에서 비극성(소수성) 부위를 제공한다. 그러므로 인지질은 양친매성이다. 수용액에서 이들의 말단극성은 물 분자를 끌어 당겨 인지질의 무리를 구성하게 된다. 인지질의 이런 특성의 세포막의 지질 이중층을 이루게 한다.
4) 스테로이드(steroid)
스테로이드는 다른 지질분자의 하위 분류와는 명백히 다른 구조를 가진다. 4개의 상호 연결된 탄소원자들의 고리는 모든 스테로이드의 골격을 형성한다. 극성을 띠는 몇개의 수산기가 이 고리 구조에 붙어 있지만, 스테로이드를 수용성으로 만들기에는 수적으로 충분하지 않다. 스테로이드의 예로써 콜레스테롤, 부신에서 생성된 코르티솔, 생식선으로부터 분비된 여성(에스트로겐)과 남성(테스토스테론) 호르몬이 있다.

단백질(protein)
단백질은 몸에서 유기물질의 약 50%를 차지하고 (체중의 17%), 거의 모든 생리적 과정에서 중요한 역할을 한다. 아래 표에서 정리.
단백질은 탄소, 수소, 산소, 질소 그리고 소량의 다른 원소 특히 황으로 구성됨. 그들은 종종 수천개의 원자를 함유한 거대분자이며, 많은 수의 작은 소단위가 중합체를 만들기 위해 탈수반응을 통해 서로 결합할때 만들어짐

주요 단백질의 종류와 기능
# 유전자 발현을 조절하는 단백질(proteins that regulate gene expression)
DNA로부터 RNA를 만듬. RNA로부터 폴리펩티드 합성
전사인자가 유전자를 활성화, RNA 중합효소가 유전자를 전사, 리보솜 단백질이 mRNA로부터 단백질로의 해독에 필요함.
# 수송단백질(transporter proteins)
이온이나 유기분자와 같은 용질이 원형질막을 통과해 이동하도록 매개함
원형질 막에 있는 이온채널이 Na+와 K+와 같은 이온들의 막을 통한 이동을 허용함.
# 효소(enzyme)
세포의 물질대사를 위해 필요한 특정화학반응 속도를 촉진함.
소장으로 분비된 췌장 리파아제, 아밀라아제, 단백질분해효소가 거대분자를 보다 작은 분자로 분해하여 창자세포가 흡수할 수 있도록 함.
단백질 인산화효소는 다른 단백질에 인산기를 붙여주는 수식으로 단백질의 기능을 변화시킴
# 세포신호 관련 단백질(cell signaling protein)
세포들로 하여금 서로간에 또는 그들 스스로 그리고 외부환경과 교통하도록 함.
원형질막 수용체가 세포외액에 있는 호르몬이나 신경전달물질과 결합함
# 운동단백질(motor proteins)
이동을 유발함
근육세포에서 볼 수 있는 미오신이 근육을 짧게 하는 수축력을 제공함
# 구조 단백질(structure proteins)
세포, 조직 및 기관을 지지하고 연결하여 보강함
콜라겐과 탄력소가 인대, 힘줄, 어떤 혈관의 지지를 제공하며, 액틴은 세포의 대부분의 세포골격을 이루고 있음.
# 방어 단백질(defense proteins0
병원체에 의한 감염과 질병으로부터 보호함
사이토카인과 항체가 외래 세포나 세균 또는 바이러스로부터 온 단백질을 공략함
단백질은 탄소, 수소, 산소, 질소 그리고 소량의 다른 원소 특히 황으로 구성되어 있다. 그들은 종종 수천개의 원자를 함유한 거대분자이며, 많은 수의 작은 소단위(단위체)가 중합체를 만들기 위해 탈수반응을 통해 서로 결합할때 만들어진다.
1) 아미노산 소단위
단백질의 소단위 단위체는 아미노산(amino acid)이다. 그러므로 단백질은 아미노산의 중합체이다. 1개를 제외한 모든 단백질은 아미노산의 중합체이다. 1개의 프롤린을 제외한 모든 아미노산은 분자내의 말단 탄소에 아미노기(-NH2)와 카르복실기(-COOH)가 결합되어 있다. 이 말단 탄소의 세번째 결합은 수소원자와 연결되어 있고, 네번째 것은 아미노산 곁사슬(amino acid side chain : 이 식에서 R로 표시)이라 불리는 나머지 분자와 결합되어 있다.이 곁사슬은 상대적으로 작은데, 하나의 수소원자로부터 수소원자를 가진 9개의 탄소원자에 이르기까지 다양하다.

살아있는 모든 생명체의 단백질은 20가지의 서로 다른 곁사슬을 가진 20가지의 서로 다른 아미노산들로 구성되어 있다. 곁사슬은 비극성(8종의 아미노산), 극성(7종의 아미노산) 혹은 이온화된 것(5종의 아미노산)일 수 있다. 인체는 많은 아미노산을 합성할 수있지만, 몇가지는 음식으로 반드시 섭취해야 하는데 이를 필수 아미노산이라고 한다.

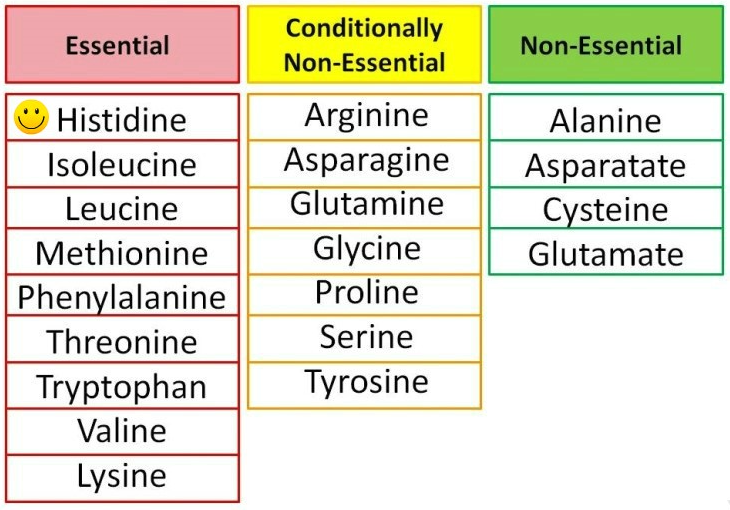
2) 폴리펩티드
아미노산은 한 아미노산의 카르복실기가 다른 것의 아미노기와 연결되어 서로 결합되어 있다. 글리코겐과 트리글리세리드의 형성에서 처럼 탈수되면서 물 한분자가 형성된다. 아미노기와 카르복실기 사이에서 형성되는 결합을 펩티드 결합이라고 한다. 펩티드 결합이 비록 공유결합일지라도 이들은 효소적으로 가수분해되어 각각의 아미노산으로 되는데, 예를들면 우리가 음식물의 단백질을 소화시킬 때 위나 소장에서 일어나는 것과 같다.

그림에서 유념해야 할 것은 2개의 아미노산이 서로 결합될때, 만들어진 분자의 한쪽 말단은 자유 아미노기를 가지고 있고, 다른 말단은 자유 카르복실기를 가지고 있다는 것이다. 부가되는 아미노산들은 이 자유 말단에 펩티드 결합으로 연결될 수 있다. 펩티드 결합으로 연결된 아미노산의 배열은 폴리펩티드로 알려져 있다. 펩티드 결합은 폴리펩티드의 기본골격을 형성하고, 각 아미노산의 곁사슬은 사슬로부터 돌출해 있다. 다시말하면, 폴리펩티드라는 용어는 구조적인 단위를 나타내는 것이지 이 분자가 기능적인 것을 반드시 제시하는 것은 아니다. 일반적으로 폴리펩티드 내의 아미노산의 수가 50개 또는 그 이하이고, 알려진 생물학적 기능을 갖고 있으면, 이 분자를 간단히 펩티드라고 하며, 이를 이 책의 관련된 곳에서는 어디서나 그렇게 사용할 것이다.
하나 또는 그 이상의 폴리펩티드가 특정 모습이 되도록 접히고 기능을 지닌 분자로 만들어졌을때 이 분자를 단백질이라고 한다. 앞에서 언급한 바와 같이 하나 또는 그 이상의 단당류들이 단백질 내의 특정 아미노산의 곁사슬과 공유결합으로 부착되어 있는 단백질은 "당단백질 glycoprotein"이라고 한다. 이들 단백질은 결합조직의 주된 요소인 원형질막에 있다. 그리고 보호 작용과 윤활작용을 하는 점액과 같은 용액에도 많이 있다.
모든 단백질은 다단계의 구조를 지니고 있으며 각 단백질은 독특한 모양으로 주어진다. 이들을 1차, 2차, 3차 구조라하고 일부의 단백질에서는 4차구조도 있다. 단백질의 모양이 생물학적 활성을 결정한다. 모든 경우에서 단백질의 모양은 아미노산의 서열인 단백질의 1차구조에 의존한다.
3) 단백질의 1차구조
두가지의 변수가 단백질의 1차구조(primary structure)를 결정한다. 1) 사슬내의 아미노산의 수 그리고 2) 사슬을 따라 각 위치에 있는 아미노산의 특정한 형태. 그림

설명 : 폴리펩티드 사슬의 1차구조는 그 사슬내의 아미노산의 배열이다. 제시된 폴리펩티드는 223개의 아미노산을 지니고 있다. 서로 다른 아미노산들은 서로 다른 색깔의 원구로 나타냈다. 번호 순서는 아미노 말단(NH2)에서 시작된다.
사슬을 따라 각 위치는 20개의 서로 다른 아미노산의 어떤 하나의 하나에 의해 차지될 수 있다. 단 3개의 아미노산 배열을 가지고 형성될 수 있는 서로다른 펩티드의 수를 생각해보자. 20개의 서로 다른 아미노산 중의 어떤 하나가 배열의 첫번째 위치를 차지하고, 마찬가지로 두번째와 세번째의 위치에도 각각 20개 중 어떤 하나가 차지한다면, 3개의 아미노산에서 모두 20*20*20=8,000가지의 배열이 가능하다. 만약 펩티드의 길이가 6개의 아미노산으로 되어 있으면, 20에 6승 = 64,000,000개의 가능한 조합이 형성될 수 있다. 단지 6개의 아미노산 길이의 펩티드는 1,000개 또는 그 이상의 아미노산 배열을 가지고 있는 단백질과 비교하여 볼때 매우 작은 편이다. 결론적으로 20개의 서로다른 아미노산을 가지고 사슬내의 아미노산 총 수나 배열을 바꾼다면 거의 무한대의 다양한 폴리펩티드가 만들어질 수 있다. 그러나 이러한 가능성이 있는 단백질의 일부만이 자연에서 발견된다.
4) 단백질의 2차 구조
폴리펩티드는 구슬 끈과 유사한데 각 구슬은 하나의 아미노산을 나타낸다. 게다가 아미노산이 폴리펩티드 사슬내에서 결합주위를 돌 수 있기 때문에, 사슬은 유연하고 마치 구슬 끈이 여러 입체 배열로 꼬아질 수 있는 것과 같이 여러가지 형태로 구부러질 수 있다. 자연상태에서 단백질들은 사슬위의 선형 구슬끈처럼 보이는 것이 아니다. 각 아미노산의 곁가지들 사이의 상호작용으로 사슬은 구부러지고, 꼬이며, 또한 접혀져 보다 밀집한 구조가 된다. 단백질의 마지막 모습을 단백질의 입체구조(conformation)이라고 한다.

폴리펩티드 사슬에 따라 여러부위들 사이의 인력은 단백질의 2차구조를 만든다. 예를들면, 수소 결합은 한 펩티드 결합에 있는 질소원자에 결합된 수소와 다른 펩티드 결합에서 이중 결합된 산소원자 사이에서 일어날 수 있다. 그림. 펩티드 결합이 폴리펩티드 사슬을 따라 일정한 간격을 두고 생기기 때문에 그들 사이의 수소결합은 고리를 알파 나선(alpha helix)라고 알려진 사슬이 꼬인 입체구조로 되게 하는 경향이 있다. 수소결합은 또한 펩티드 결합들 사이에서 폴리펩티드 사슬의 연장된 부위가 거의 서로 평행되게 나아갈때에도 형성될 수 있는데 이렇게 비교적 곧게 뻗어나간 부위를 베타 병풍(peta pleated sheet) 구조라고 한다.
그러나 몇가지 이유로 폴리펩티드 사슬의 정해진 부위가 알파 나선이나 병풍 입체구조를 취하지 않을 수도 있다. 예를들어 곁사슬의 크기와 반대로 하전된 곁사슬들 사이의 이온결합의 존재는 이러한 형태를 만드는데 요구되는 반복되는 수소결합을 방해할 수 있다. 임의의 고리입체구조라고 알려진 불규칙한 부위는 더 규칙적인 알파 나선과 베타병풍유형들을 연결하는 부위에서 나타난다.
베타병풍과 알파나선은 단백질이 원형질막과 같은 지질이중층에 고정되게 하는 능력을 주는데, 이는 단백질의 이 부위가 일반적으로 소수성 곁가지를 지닌 아미노산을 지니고 있기 때문이다. 곁가지의 소수성은 이들이 원형질막의 지질 환경내에 보다 많이 남게 한다.
5) 단백질의 3차구조
일단 2차구조가 형성되면 추가적인 아미노산 곁사슬들 사이에 결합이 가능해진다. 예를들면, 폴리펩티드의 선형 서열에서 서로 사호작용을 하기에는 너무 멀리 떨어져 있는 2개의 아미노산이 일단 2차구조로 인해 분자의 구조가 바뀌어지면서 서로 매우 가깝게 될 수 있다. 이런 상호 작용이 폴리펩티드로 하여금 마지막 3차원적 입체구조로 접힌다. 일단 이미노산 서열(1차구조)이 형성되고 나면 폴리펩티드 사슬의 마지막 입체구조인 3차구조를 결정하는 다섯가지 요소가 있다.
이들은 1) 사슬의 부분들간이나 주위의 물분자들과의 수소 결합 2) 사슬을 따라 극성부위와 이온화된 부위 사이의 이온결합 3) 비극성(소수성) 부위 사이의 인력 4) 2개의 시스테인 아미노산의 황을 지닌 곁사슬을 연결하는 공유 이황화결합(disulfide bond) 그리고 5) 서로 매우 인접한 두 분자들의 가장 바깥쪽 껍질을 선회하는 전자들 사이의 매우 약하고 일시적인 상호작용인 반데르발스힘이다.
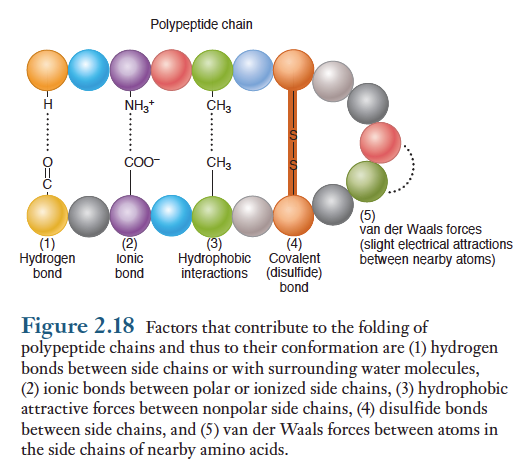
6) 단백질의 4차구조
어떤 단백질은 하나 이상의 폴리펩티드 사슬로 구성되어 있는데, 이들은 4차구조를 가졌다고 말하고, 많은 부분을 지닌 다량체 단백질이다. 하나의 폴리펩티드의 입체구조에 영향을 미치는 요인들이 동일하게 다량체 단백질에서도 폴리펩티드들 사이의 상호작용에 관여한다. 그러므로 사슬들 사이에 이황화 공유결합뿐만 아니라 다양한 이온화, 극성, 비극성의 곁사슬들 사이의 상호작용에 의해서 사슬들은 서로 결합할 수 있다.
다량체 단백질은 다양한 기능을 가지고 있다. 다량체 단백질의 폴리펩티드 사슬들은 동일한 것이거나 또는 서로다른 것일 수도 있다. 예를들면 혈액에서 산소를 운반하는 단백질인 헤모글로빈은 한종류가 2개이고, 다른 종류가 2개로 모두 4개의 폴리펩티드 사슬을 지닌 다량체 단백질이다. 그림.

각 소단위는 1개의 산소분자를 운반할 수 있다. 이 책에서 배우게될 다른 다량체 단백질들로는 세포내외로 작은 용질들의 이동을 용이하게 하는 원형질막에 구멍을 만드는 역할을 하는 채널이 있다. 많은 단백질들의 1차구조(아미노산 서열)는 알려져 있지만, 3차원적 입체구조의 결정은 단지 일부만이 알려져 있다. 폴리펩티드 사슬의 접힘에 영향을 미칠 수 있는 복합요인때문에 1차 아미노산 순서로부터 단백질의 입체구조를 정확하게 예측하는 것은 아직 가능하지 않다. 그러나 단백질의 1차구조의 변화가 2차, 3차,4차 구조를 변화시키는 것은 명백하다. 이와같은 1차구조의 변화를 돌연변이(mutation)이라고 한다.
돌연변이에 의해 생긴 단 하나의 아미노산 변화라도 헤모글로빈 베타사슬에 있는 글루탐산 분가가 발린 분자로 대체되었을때와 같은 파괴적인 결과를 가져온다. 이런 변화의 결과는 낫형-세포 질환(sickle-cell disease)라 불리는 심각한 질병이다. 이 질병을 가진 사람의 적혈구가 낮은 산소 수준에 노출되면, 그들의 헤모글로빈은 응결된다. 그에 따라서 적혈구가 초승달 모양으로 찌그러지고 깨지기 쉬우며 정상적인 기능을 할수 없게 된다.

핵산(nucleic acid)
핵산은 몸무게의 단지 2%만을 차지하고 있지만 이 분자들은 유전정보의 저장, 발현 그리고 전달에 책임이 있기 때문에 매우 중요하다. 특정 단백질 형태로의 유전정보의 발현이 개체가 인간인지 쥐인지 또는 세포가 근육세포인지 혹은 상피세포인지를 결정한다.
핵산은 데옥시리보핵산(deoxyribonucleic acid, DNA)과 리보핵산(ribonucleic acid, RNA)의 두종류가 있다. DNA분자는 유전자의 서열에 암호화된 유전정보를 저장하고 있는 반면에 RNA 분자는 이정보를 특정 폴리펩티드 사슬로 만들기 위해 아미노산들을 서로연결시켜 특별한 서열로 하게 하는 지침으로 삼아 해독하는데 관여한다.
핵산의 두가지 유형은 모두 중합체이고 반복되는 소단위의 선형 서열로 구성되어 있다. 각 소단위는 뉴클레오티드(nucleotide)라고 알려져 있는데, 인산기, 당, 수소이온을 받을 수 있기 때문에 염기로 알려진 탄소와 질소원자로 된 고리의 세가지 구성요소로 되어 있다. 그림 2.20

하나의 뉴클레오티드의 인산기는 사슬을 형성하기 위해 인접한 뉴클레오티드의 당과 연결되어 있고, 염기는 인산-당 골격의 측면으로 돌출해 있다. 그림 2.21



1) DNA
DNA의 뉴클레오티드는 5탄당인 데옥시리보오스를 함유한다(그래서 이름이 데옥시리보 핵산이다). DNA에는 네가지 서로다른 뉴클레오티드가 있는데 각각은 데옥시리보오스에 연결될 수 있는 서로 다른 네가지의 염기에 해당된다. 이 염기들은 두종류로 분류된다. 퓨린(purine) 염기인 아데닌(adenine, A)과 구아닌(guanine, G)으로 질소와 탄소원자로 된 2개의 고리를 가지고 있다. 피리미딘(pyrimidine)염기인 시토신(cytosine, C)과 티민(thymine, T)은 단지 하나의 고리를 가지고 있다.

DNA분자는 하나가 아닌 2개의 뉴클레오티드 사슬이 서로 꼬아져 있는 이중 나선형태를 이룬다. 2개의 사슬은 한 사슬의 퓨린염기와 반대사슬의 피리미딘 염기 사이에 수소결합으로 서로 연결되어 있다. 각 염기의 고리구조는 인산-당 골격에 수직인 평면으로 놓여 있어 마치 나선형의 계단과 같다. 이 염기 쌍은 서로 꼬아짐으로써 두 사슬의 당-인산 골격사이에서 일정한 거리를 유지한다.
4개의 염기에서 수소결합기의 위치에 따라 염기쌍의 특이성이 부여된다. 퓨린 구아닌과 피리미딘 시토신(G-C쌍) 사이에 3개의 수소결합이 형성되는데 반하여, 퓨린 아데닌과 피미미딘 티민(A-T쌍) 사이에서는 단지 2개의 수소결합이 형성된다. 결과적으로 G는 항상 C와 A는 T와 쌍을 형성한다. 이 특성이 유전정보를 복제하고 전달하는 메커니즘을 제공한다.

염기들 사이의 수소결합은 효소에 의해 깨질 수 있다. 이런 분리는 이중 나선을 2개의 가닥으로 만드는데 이를 DNA변성이라고 한다. 각각의 한가닥은 2개의 새로운 DNA 분자가 되도록 복제된다. 이는 세포분열시에 일어나고 각 딸세포는 완전한 DNA전체를 갖는다. 시험관내에서 DNA는 또한 열에 의해 결합을 깰 수 있는데, 이는 연구자들이 DNA복제와 같은 과정을 연구하는데 편리한 방법으로 사용된다.
2) RNA
RNA분자는 DNA와는 몇가지 차이가 있다. 첫째, RNA는 하나의 뉴클레오티드 사슬로 되어 있으며, 둘째, RNA에서 각 뉴클레오티드의 당은 데옥시리보오스가 아닌 리보오스(ribose)이며, 그리고 셋째, DNA의 피리미딘 염기인 티민은 RNA에서 피리미딘 염기인 우라실로 대체되며, 퓨린인 아데닌과 염기쌍(A-U쌍)을 이룰 수 있다. 다른 세가지 염기인 아데닌, 구아닌, 시토신은 DNA와 RNA모두에서 동일하다. RNA가 단지 하나의 뉴클레오티드 사슬을 가지고 있기 때문에 이 사슬 부분은 자체적으로 접힐 수 있고 동일 사슬의 뉴클레오티드나 다른 DNA나 RNA분자의 뉴클레오티드와 염기쌍을 형성할 수 있다.
ATP
퓨린 염기는 DNA나 RNA 합성에서뿐만 아니라 모든 세포의 분자 에너지의 원천으로도 중요하다. 세포의 기능발현은 이 장에서 논의되는 유기분자안에서의 화학적 에너지를 뽑아내고 사용하는 능력에 달려있다. 예를들어 산소가 존재할때, 세포가 포도당을 이산화탄소와 물로 분해시키면 에너지가 유리된다. 이러한 에너지의 일부는 열의 형태이지만, 세포는 그 기능을 수행하는데 있어서 열에너지를 사용할 수 없다. 그 나머지의 에너지는 다른 분자 또는 에너지를 필요로 하는 과정에 차례로 전달할 수 있는 다른 중요한 분자에 전달된다.

모든 세포에서 ATP(adenonsine triphosphate)는 탄수화물, 지방, 단백질과 같은 연료분자의 분해로부터 얻는 에너지를 전달받는 일차적 분자이다. 유기분자에서 유리된 에너지는 아데노신 분자에 인산기를 첨가하는데 사용된다. 이 저장된 에너지는 그 다음에 가수분해에 의해서 방출될 수 있다.
ATP + H2O ---> ADP +Pi +H + 에너지
반응산물은 에네노신2인산(adenosine diphosphate, ADP), 무기인산(Pi)과 H+ 이다. ATP의 가수분해로부터 유래한 에너지는 세포에 의해 1) 근육수축에서처럼 힘과 운동의 생산 2) 막을 통한 분자의 능동수송 3) 세포구조와 기능에 사용되는 유기분자의 합성에 사용된다. 우리는 세포가 에너지를 저장하기 위해서가 아니라 에너지를 전달하기 위해서 사용한다는 것을 강조해야만 한다. ATP는 에너지를 필요로 하는 세포과정을 위해 연료분자로부터 상대적으로 적은 양의 에너지를 전달하는 에너지 운반 분자이다.