에틸렌
Ethylene
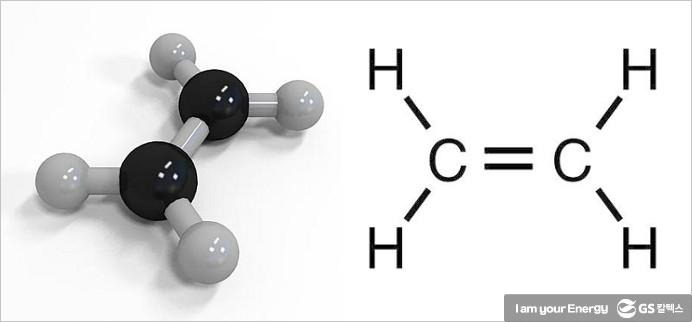
IUPAC 정식 명칭은 "에텐(Ethene)". 알켄 중에 가장 간단한 형태를 가지는 물질로, 여러 가지 화합물을 만드는 재료가 된다. 화학식은 C2H4이다.

식물의 노화/성숙을 돕는 호르몬으로 작용하며, 덜 익은 과일을 익히는 데에 이용될 수 있다. 특히나 잘 익은 사과와 바나나에서 에틸렌이 많이 분출되며, 이를 다른 과일들과 같이 둘 경우 다른 과일이 썩어버릴 수도 있다.
식물이 물리적 손상, 바이러스 침입, 외부환경 불량(가뭄/산소부족/냉해/사람 손길) 등 스트레스를 받으면 활발히 생성된다. 저장고 내 공기에 1ppm(0.0001%)만 존재해도 작물, 씨앗의 노화와 퇴색 및 변질 등을 유발할 수 있다. 다량 노출시 식물이 시들고 황화(노랗게 변색)되며 잎과 꽃, 열매까지 수명이 단축된다. 따라서 과일 저장업자들에게도 에틸렌은 골칫거리다. 저장한 과실의 부패와 퇴색을 촉진해 손해를 입히기 때문이다.
그런데 이런 에틸렌은 광범위한 화합물 제조에 사용된다. 대표적으로 에틸렌을 중합시키면 고분자 화합물인 폴리에틸렌이 된다. 'PE'라고 써 있는 바로 그거다. 가장 간단한 형태의 고분자 화합물이자 수많은 고분자 화합물들의 시발점이 된 물질이다.
그 밖에도 산화시켜 산화에틸렌을 만드는데도 사용된다. 산화에틸렌은 물과 반응해 자동차 부동액이나 페트병에 쓰는 에틸렌글라이콜을 만든다. 에틸렌글라이콜을 산화에틸렌과 재차 반응시키면 바로 폴리에틸렌글라이콜, 즉 피이지(PEG)가 나온다. 피이지는 단독으로 혹은 폴리프로필렌글라이콜(PPG), 지방산 등과 결합해 유도체로 쓴다. 화장품, 세정제, 식품, 의약품, 신약개발, 피임약 등 다양한 분야에 사용된다. 피이지 유도체는 주로 계면활성제나 유화제로 사용된다.
흥미롭게도 에틸렌, 폴리에틸렌, 페트병, 산화에틸렌, 에틸렌글라이콜, 피이지, 피이지 유도체 모두 독성, 민감성, 환경호르몬 논란 등으로 종종 논쟁에 휩싸인다.
위에 나왔듯 정식 명칭은 '에텐(Ethene)'이지만 유기화학을 배우지 않는 한, 이를 아는 사람들은 거의 없었다. 그러나 최근 개정된 화학Ⅰ에선 '에텐(Ethene)'이라는 명칭을 사용한다. 아예 IUPAC(International Union of Pure and Applied Chemistry, 국제 순정·응용 화학 연합)에서도 산업 현장에서 워낙 널리 쓰이기에 에틸렌이라는 명칭을 '관용명'으로서 인정한 상태이다.
사용처
에틸렌은 플라스틱과 합성섬유를 만드는데 사용되는 핵심 재료로 주로 사용된다. 국내의 석유화학 공장에서는 납사(나프타)를 분해하여 에틸렌을 생산하고, 이것으로 폴리에틸렌과 같은 플라스틱을 생산한다. 최근에 미국에서 셰일 가스의 생산량이 많아지며 미국의 석유화학 공장에서는 셰일 가스의 에틸렌을 직접 사용하여 경쟁력을 높이고 있다.
이외에도 LPG 가스 용접/절단에 사용되기도 한다.
식물 호르몬으로 작용하는 특성이 있어 바나나, 키위, 아보카도 등 수확 후 후숙이 필요한 과일들을 후숙하는데 쓰인다. 제2차 세계 대전 당시 태평양 전선의 일본군은 현지에서 조달한 바나나를 포탄 구덩이에 넣어 숙성시켜 먹곤 했다. 포탄의 주원료인 TNT가 연소되고 남은 탄화수소가 식물 호르몬으로 작용하여 바나나를 숙성시키는 원리를 이용한 것인데, 당연히 그들이 이 사실을 알고 한 것은 아니고 경험적으로 깨달은 것이다.
이처럼 꼭 에틸렌 가스가 아니라 탄화수소 가스이기만 하면 과일 후숙에 쓸 수 있기 때문에 과일 도매상들이 카바이드를 사용해 아세틸렌 가스를 만들어 과일을 숙성시키기도 했다.
그런데 이 공기에 섞여 있던 성분이 지하에서 조금씩 방출되며 에틸렌이라는 추측을 불러일으킵니다. 실제로, 에틸렌은 사향 비슷한 냄새를 풍기며 동시에 달짝지근한데요. 따라서 에틸렌가스를 흡입해 환각 상태에 도달한 사제들이 아폴로신의 신탁을 전했다고 믿어집니다. 재미있는 이야기지만 과학적 증거는 부족합니다.
에틸렌 기체의 발견 년도는 1669년으로 봐야 할 것 같습니다. Johann Joachim Becher(1635-1682, 독일)는 이 해에 에탄올을 황산과 탈수반응시켜 에틸렌을 얻었으며, 후에 Jan Ingenhousz(1730-1799, 네덜란드)도 에틸렌을 합성했습니다.
1795년경 Johann R. Deimann 등 4명의 네덜란드 과학자들은 에틸렌 기체를 염소와 반응시켜 1,2-디클로로에탄 액체를 얻었습니다. 이때 이들은 출발물을 기름을 만드는 기체(olefiant gas)라고 불렀으며, 이 명명은 올레핀(olefin)이라는 이름의 기원이 되었습니다.
그런데 왜 우리는 올레핀이니 알켄이니 하는 두 가지 다른 용어를 쓸까요? 그 후 독일 화학자 August W. von Hofmann의 제안 및 IUPAC(국제순수응용화학연합)의 추천을 통해 올레핀 대신 알켄(에텐)이라는 이름이 공식화되었으나 아직도 에틸렌이라는 명칭이 널리 쓰이고 있습니다.
IUPAC 명명법이 세계적으로 통용되는 공식명칭이지만 전통적으로 사용되어온 이름들이 혼용되고 있어 자칫 혼란을 줄 수 있기 때문입니다.
ohann Joachim Becher(1635-1682, 독일)
Lummus 에틸렌 공정에는 SRT(Short Residence Time) 열분해 히터 기술이 가장 중요합니다. 현재 우리나라는 에틸렌을 연간 835만여 톤 생산하고 있으며, 이는 세계 5위에 해당하는 생산능력입니다. 에틸렌 사용은 매우 다양하며, 가장 큰 소비처는 플라스틱 중에서도 가장 많이 사용되는 폴리에틸렌(PE)의 제조입니다.

이 중에서 산화에틸렌, 디클로에탄, 에틸벤젠이 가장 중요하며, 폴리에틸렌 제조와 이들의 합성에 에틸렌의 약 90%를 사용합니다. 도대체 이 세 화합물들이 어디에 쓰이기에 그럴까요?
우선 산화에틸렌(EO)을 살펴보겠습니다. 에틸렌을 산화시켜 얻는 이 화합물은 다양한 계면활성제에 쓰입니다. 산화에틸렌을 수화시키면 에틸렌글리콜(EG)이 얻어지는데 이 화합물은 자동차의 부동액 원료이며, 또 테레프탈산과 중합해 폴리에스테르(섬유, 플라스틱용)를 제조합니다.
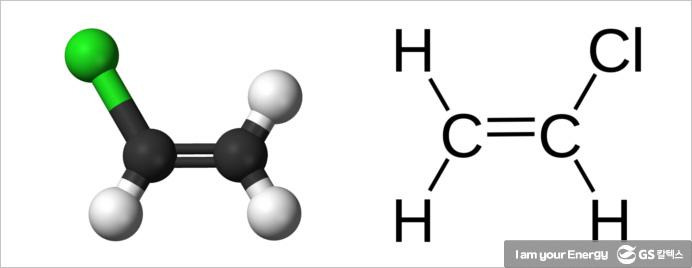
에틸렌은 산화조건에 따라 아세트알데히드, 아세트산(초산)이 되기도 합니다. 에틸렌의 할로겐화와 할로겐화수소화는 이염화에틸렌, 염화에틸, 이브롬화에틸렌 등을 제공합니다. 옥시염화반응으로 염화비닐(CH2=CHCl)을 만들고 중합하면 폴리염화비닐(PVC)이 되는데, 물론 이 단위체는 여러 가지 염화비닐 공중합체 제조에 사용되기도 합니다. 염화물들은 다른 유기화합물 합성에 중요한 출발물입니다.
스티렌은 폴리스티렌(PS) 및 다양한 공중합체(플라스틱) 제조의 원료가 됩니다. 흔히 PE, PS와 PVC를 삼대 플라스틱이라 부르는데, 이들이 모두 에틸렌의 자손들입니다.
또 에틸렌은 산촉매 존재하에 수화시키면 합성에탄올이 됩니다. 이같이 제조한 합성에탄올은 의료용 소독 알코올로 사용되며, 화학공업 원료로도 넓게 사용되고 있습니다. 이밖에도 에틸렌은 화학공업의 출발 원료로 훨씬 더 다양하게 쓰이며, 화학공업의 왕자의 자리를 굳게 지키고 있습니다.
따라서 에틸렌 기체는 과일을 빨리 익히거나, 개화를 촉진하거나 늦출 때 사용하기도 합니다. 식물계와 동물계의 생리학적인 차이가 너무도 큼에 놀랄 뿐입니다. 앞으로 식물계 에틸렌에 대한 더 많은 연구가 기대됩니다.
