친핵체와 친전자체, Nucleophile and electrophile
친핵체(Nucleophile)는 상대적으로 전자를 많이 가지고 있는 원자단이며, 친전자체(Electrophile)는 상대적으로 전자가 적어 전자를 얻고 싶어하는 원자단이다. 친핵체와 친전자체의 반응을 통해 여러 화학반응이 개시된다. 루이스 산염기의 관계와 같다. 다만, 일반적으로 산염기는 수소 원자를 공격하는 경우이고, 친핵체와 친전자체는 탄소 원자를 공격하는 경우에 사용한다.
아래 예시에 알킬기가 들어간다면 알킬기가 수소로 치환된 화합물도 마찬가지이다.
친핵체
알칼리 금속(특히 세슘)
알칼리 토금속
알루미늄
알코올과 알코올의 H+가 떨어진 상태
싸이올과 싸이올의 H+가 떨어진 상태
철
생화학
아미노기
친전자체
과산화물
산소
(산성)수소
탄소 양이온 중간체
할로젠 원소(특히 플루오린)
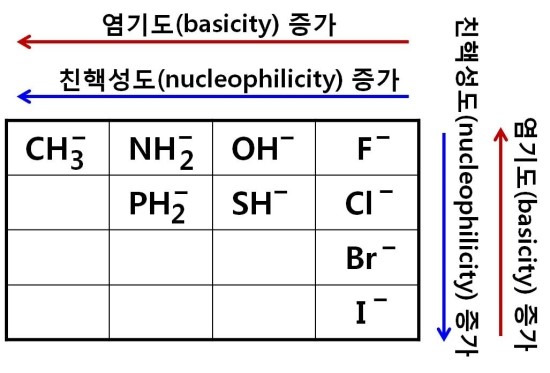
친핵성은 그자신은 음성(-)이며 염기성이고, 따라서 전자쌍(-)을 제공하며 양성(+)과 결합하는 성질이 있습니다. 위의 표는 음(-)의 성질을 가지는 것들을 pKa값을 기준으로 염기도(염기성도)의 크기를 나타낸 것입니다. 염기도가 증가할수록 강염기이며, 이때 pKa값은 커집니다. 염기도가 증가할수록 음성(-)이 강합니다(전기음성도 증가).
하지만 친핵성도와 염기도가 항상 일치하지만은 않습니다. C,N,O,F는 염기도와 친핵성도가 일치하며, F,Cl,Br,I는 서로 반대입니다. 이것은 입체장애, 원자의 크기, 용매의 차이 등 여러가지 요인이 작용하기 때문입니다. 같은 주기에서는 입체장애가 낮을수록 친핵성도가 크며, 같은 족에서는 원자크기가 클수록 분극이 커져서 친핵성도가 큽니다.
전기음성도가 작은 물질을 강한 친핵체라고 부릅니다(전기음성도가 낮으면 전자쌍을 잘 준다. 예를들어 질소가 산소보다 전기음성도가 낮기 때문에 암모니아는 물보다 더 강한 친핵체이다. 이것은 암모니아의 질소에 전자쌍이 물에 결합되어 있는 산소의 전자쌍보다 더 느슨하게 결합되어 있기 때문이고, 그 결과 암모니아의 질소 전자쌍은 전자가 부족한 탄소에 결합을 형성하기 위해 더 쉽게 기증된다.). 예를들어 양성자성 극성용매에서 I−은 Br−보다 더 강한 친핵체입니다. 반면 비양성자성 극성 용매는 용매와 친핵체 사이에서 수소결합이 생성하지 않기 때문에 친핵체는 주기율표상에서 위로 올라갈수록 강해집니다. 이경우 친핵체의 힘은 염기의 강도에 비례합니다. 따라서 I−은 Br−보다 염기는 약하기 때문에 약한 친핵체입니다. 강한 친핵체나 음이온인 친핵체는 친핵 치환 반응에서 SN2 반응을 일으키기 쉽습니다.
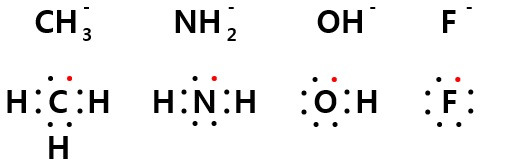
같은 주기에서 양성자와 공유할 수 있는 비공유전자쌍은 C, N, O, F에 있습니다. 이들 중 탄소는 전기음성도가 가장 낮으므로 전자를 가장 많이 공유하려고 합니다. 따라서 CH3 음(-)이온이 가장 강한 염기나 마찬가지입니다(전자쌍을 잘 주므로 강한 루이스염기). 이때 강한 친핵체입니다. F는 가장 전기음성도가 높기 때문에 F 음(-)이온은 전자를 공유할 의사가 가장 적습니다. 따라서 가장 약한 염기입니다(전자쌍을 잘 내놓지않으므로 약한 루이스 염기. 가장 약한 친핵체.).
주의할것은 F 음이온이 가장 약한 염기이며 루이스염기라고 해서 산이라는 의미는 아닙니다. 어디까지나 약한 염기이지 루이스 산은 아닙니다. 즉, 친전자체가 아닙니다. 따라서 전자쌍을 잘 내놓지않는다는 개념이지 전자쌍을 잘 뺏어온다는 개념이 아닙니다. 전자쌍을 뺏어오지는 못합니다(전자쌍을 뺏어올 공간도 없음.).
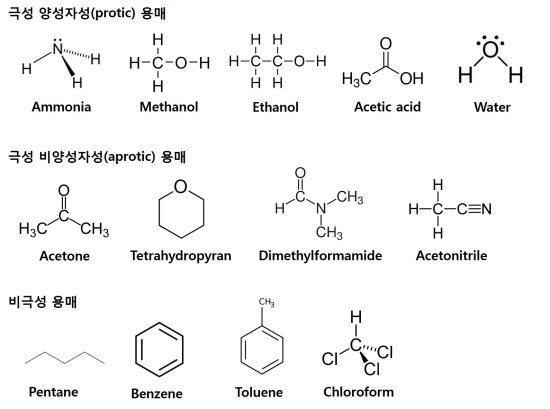
또한 용매에 따라 친핵성도가 달라지는데, 물과 같은 극성 양성자성 용매에서는 F- < Cl- < Br- < I- 이고, 아세톤과 같은 극성 비양성자성 용매에서는 F- > Cl- > Br- > l- 가 됩니다. 극성 양성자성 용매와 극성 비양성자성 용매는 둘다 극성이지만, 극성 양성자성 용매에는 하이드록시기, 아민기를 가져 즉, O-H, N-H와 같이 수소를 가지고 있어 양성자(+)를 제공할 수 있습니다. 반면 극성 비양성자성 용매는 하이드록시기와 아민기가 부족합니다. 이들은 양성자 수용체입니다.
유전상수(dielectric constant)가 15이상인 용매는 극성(polar)으로써 이때 양성자성(protic)과 비양성자성(aprotic)으로 더 나눌 수 있습니다. 유전상수가 클수록 극성인데 예를들어 물의 쌍극자 모멘트는 메탄올보다 높으므로 물은 메탄올보다 더 극성입니다. 양성자성 용매는 수소 결합을 통해 음이온(음전하를 띤 용질)을 강하게 용매화 시킵니다. 물은 양성자성 용매입니다. 반면 아세톤이나 디클로로메탄과 같은 비양성자성 용매는 음의 쌍극자를 통해 양이온(양전하를 띤 용질)을 용매화 시키는 경향이 있습니다. 화학 반응에서 극성 양성자성 용매의 사용은 SN1 반응 메커니즘을 선호하는 반면 극성 비양성자성 용매는 SN2 반응 메커니즘을 선호합니다. 이러한 극성 용매는 물과 수소 결합을 형성하여 물에 잘 용해되는 반면 비극성 용매는 강한 수소 결합을 할 수 없습니다.
비록 친핵성(nucleophilicity)과 염기도(basicity)가 서로 관련이 있는 유사한 성질이지만, 근본적으로는 다른 의미입니다.
친핵성 : 전자가 결핍된 원자(주로 중심 탄소)에 전자가 풍부한 종이 전자쌍을 주면서 공유결합을 형성하는 반응성으로써, 이것은 산과 염기반응에서 반응속도상수 k로 나타나는 운동학적 성질이다.
염기도 : 양성자(수소이온, H+)를 받아들여 안정한 생성물을 형성하는 능력을 측정하는 것입니다. 어떤 원자가 양성자를 받아들이며 다른 원자에 얼마나 쉽게 전자쌍을 주는지에 대한 척도. 이것은 산과 염기반응(주로 중화반응)에서 평형상수 ka로 나타나는 열역학적 성질이다.
친핵은 nucleophilic, 친핵성은 nucleophilicity, 친핵체는 nucleophile로써 서로 의미는 비슷합니다. 친핵성(nucleophilicity)은 양전하(+)를 띤 원자핵과 결합하기 위한 친핵체(nucleophile)의 노력이나 능력 또는 친화력을 말합니다. 따라서 친핵체는 뭔가 음(陰의 본성, = 이중결합, : 전자쌍, - 음이온, π 전자, 공명 등)의 성질이 강하며 따라서 전자쌍을 주는 성질이 강합니다.
전자와 전자쌍의 개념은 다릅니다. 전자는 전자 한개를 의미하고, 전자쌍은 전자 두개를 의미하므로, 전자쌍을 준다는 것은 전자를 두개 준다는 것입니다. 즉, 말그대로 전자쌍입니다. 본래 친전자체나 친핵체의 개념은 전자쌍의 이동 개념입니다. 즉, 한개의 전자가 아니라 한쌍의 전자가 본래 개념입니다. 즉, 루이스산(친전자체)과 루이스염기(친핵체)의 개념입니다. 예를들어 NaCl의 Na+와 Cl-에서 Na+는 친전자체이며 전자를 쌍으로 받으므로 루이스산입니다. Cl-은 친핵체이며 전자를 쌍으로 주므로 루이스염기입니다. 물론 NaCl은 전자쌍 결합이 아니라 Na가 Cl에게 전자를 하나만 주는 이온결합입니다. 이들은 수용액에서 Na+와 Cl-로 분해(이온화)되어 존재합니다. 이렇게 되면 비로서 Na+와 Cl-는 각각 친전자체, 친핵체가 됩니다.
▶ 서로 전자를 1개만 준다 : 공유결합. 친핵체와 친전자체를 구분할 수 없다.
▶ 한쪽이 전자를 1개만 준다 : 이온결합. 친핵체와 친전자체를 구분할 수 없다. 염소의 경우 친전자성이 있지만 전자를 한개만 받으므로 친전자체는 아니다.
▶ 한쪽이 전자를 1+1으로 준다 : 배위결합. 이경우 친핵체와 친전자체가 결합한다. 이때 친핵체(루이스염기)는 한쌍의 전자를 기증하는 종(분자 또는 이온)이다.
모든 원소와 분자를 친핵성인지? 친전자성인지?는 구분하기 어렵고(만약 전자쌍의 이동이 명확하다면 확실하겠지만), 아래와 같이 잘 알려진 친핵성 혹은 친전자성 분자들이 있습니다.
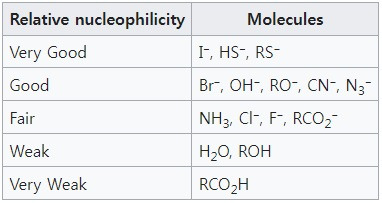
<상대적인 친핵성>
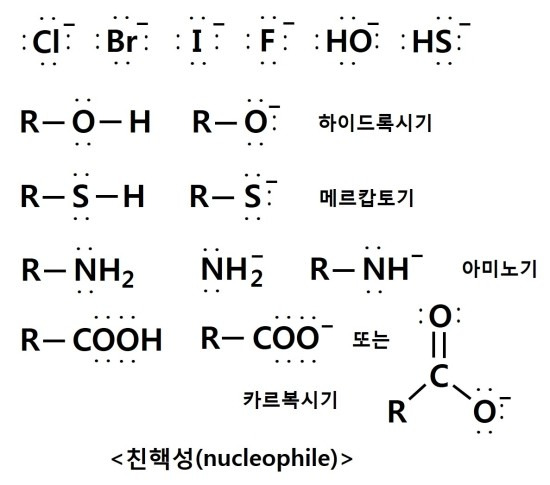
친핵성은 음이온을 가지며, 전자쌍을 많이 가지고 있어서 전자쌍을 주므로 루이스 염기입니다.
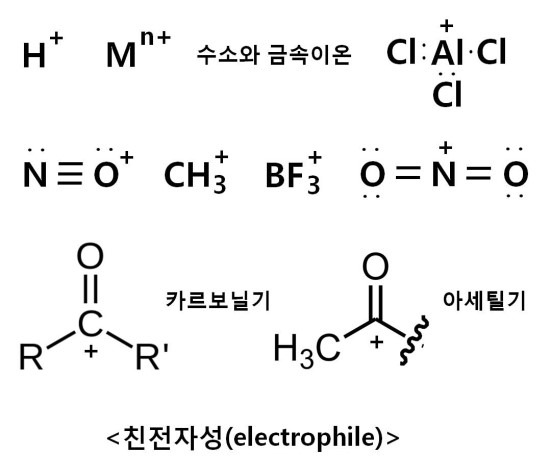
친전자성은 양이온을 가지며, 전자쌍을 적게 가지고 있어서 전자쌍을 받으므로 루이스 산입니다.
친핵성은 전자가 남아서 음전하를 가지고 있고, 친전자성은 전자가 부족하여 양전하를 가지고 있는 상태입니다.

위의 그림에서 염소(Cl)는 전자쌍을 주거나 받을 수 없으므로, 친전자체나 친핵체가 아닙니다. 따라서 루이스 산이나 염기도 아닙니다. 염소 양이온은 전자쌍을 받을 수 있어서 친전자체나 루이스 산입니다. 염소 음이온은 전자쌍을 줄 수 있어서 친핵체나 루이스 염기입니다. 한편 가운데 염소는 라디칼(불안정하고 반응성이 크다.)로써 산화와 환원 반응에 참여합니다. 주로 상대를 산화시키며 자신은 환원되는 산화제 역할을 합니다.
메틸기(-CH3)는 보통 전자 공여체(기증) 입니다. 다만 그전에는 친전자체나 친핵체가 아닙니다. 만약 전자를 기증하여 양이온이 되면 친전자체가 되고, 음이온이 되면 친핵체가 됩니다.
▶ 첨가반응 : 이중결합등 불포화결합에서 다른 분자가 결합하는 반응. 단일결합이 된다.
▶ 치환반응 : 분자의 전자밀도가 낮은 부분을 전자밀도가 높은 친핵성(-)분자가 공격하여 자리를 뺏는 친핵성치환반응과 분자의 전자밀도가 높은 부분을 전자밀도가 낮은 친전자성(+)분자가 공격하여 자리를 뺏는 친전자성치환반응이 있다.
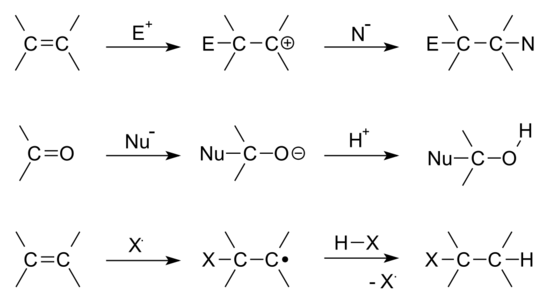
<그림출처 : addition reaction - 위키백과>
위에서부터 친핵체인 알켄에 친전자체(E+)를 첨가하는 친전자성 첨가반응(electrophilic addition), 친전자체인 카르보닐에 친핵체(Nu-)를 첨가하는 친핵성 첨가반응(nucleophilic addition), 알켄에 할로겐화물(X)의 자유라디칼 첨가반응 입니다. 친전자성 첨가반응은 친핵체인 알켄, 알카인 등에서 친전자체(E+)의 공격에 의해, 친핵성 첨가반응은 친전자체인 카르보닐(알데하이드, 케톤) 등에서 친핵체(NU-)의 공격에 의해 주로 발생합니다. 친전자성 첨가반응의 기질(substrate)은 알켄이나 알카인처럼 무조건 이중결합 또는 삼중결합을 가지고 있어야 합니다(전자가 풍부한 불포화 C=C 결합). 알켄, 알카인은 친핵체로써 친전자체(E+)에게 전자쌍을 줄 수 있습니다.
▶ 친핵체(nucleophile) : 친전자체(electrophile)에게 전자쌍을 주며 결합.
▶ 친전자체(electrophile) : 친핵체(nucleophile)에게 전자쌍을 받으며 결합.
따라서 친핵성 기질에 친전자체가 첨가되면 친전자성 첨가반응, 친전자체 기질에 친핵체가 첨가되면 친핵성 첨가반응. 결국 친핵체과 친전자체가 결합합니다.
친전자체는 중심원자에 양(+)전하를 띠고있거나, 전자가 많은 중심에 끌리고 싶어하는 빈 오비탈을 갖고 있는 중성 분자입니다. 친전차체는 E+의 기호를 사용하고 여기서 E는 전자가 아닙니다. Nu-인 친핵체는 자유 전자쌍이나 최소한 하나의 파이결합을 가진(이중결합 이상) 분자나 음이온은 친핵체로 작용할 수 있습니다. 예를들면 파이전자가 풍부한 벤젠은 친핵체입니다. 할로겐족 원소는 전자 하나를 더 얻고 싶어하는 친전자체 입니다. 하지만 할로겐이 음이온이 되면 친핵체가 됩니다. 친전자체는 전자를 받기 때문에 루이스 산이고, 친핵체는 전자를 주기 때문에 루이스 염기 입니다.
■ 친핵성 첨가반응(nucleophilic addition)
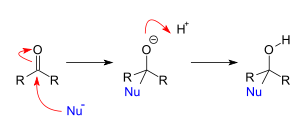
<그림출처 : Nucleophilic addition - 위키백과>
위의 그림은 친핵성 첨가반응으로 카르보닐기는 친전자성(+)으로 친핵성(Nu-) 분자와 결합하여 반응물로 광학대칭성을 가지는 라세미체가 되었습니다.
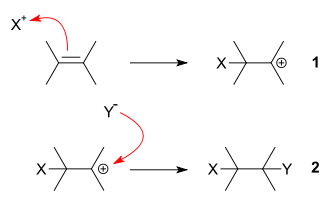
이중결합 알켄은 친핵체로 작용하기도하고 친전자체로 작용하기도 합니다. 위의 그림은 알켄이 친핵체로 작용하는 모습입니다. 1. 친전자성(X+) 분자가 알켄족 탄화수소의 이중결합을 깨뜨리며 공유결합하게 됩니다(친전자성 첨가). 양이온을 받아 상대적으로 약하게 양(+)으로 하전된 탄소는 2. 친핵성(Y-) 분자와 결합하여 첨가반응이 진행됩니다(친핵성 첨가). 기본적으로 이중결합의 불포화시스템은 파이전자에 전자밀도가 높으므로 친핵성을 띱니다(따라서 친전자성 첨가를 겪는다.).

위의 그림은 알켄이 친전자체로 작용하는 모습입니다. 1. 친핵성(X-) 분자가 알켄족 탄화수소의 이중결합을 깨뜨리며 공유결합하게 됩니다(친핵성 첨가). 음이온을 받아 상대적으로 약하게 음(-)으로 하전된 탄소는 2. 친전자성(Y+) 분자와 결합하여 첨가반응이 진행됩니다(친전자성 첨가).
■ 친핵성 치환반응(nucleophilic substitution)
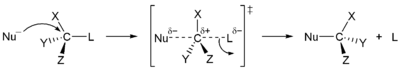
<SN2 치환 반응>
<그림출처 : Nucleophilic substitution - 위키백과>
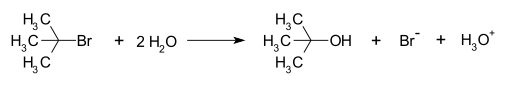
친핵성 치환 반응에는 기본적으로 SN2와 SN1이 있습니다. 이 반응은 서로 경쟁적으로 발생합니다. SN2반응은 극성 비양성자성 용매에서, SN1은 극성 양성자성 용매에서 더 잘 나타납니다. SN은 친핵성 기질을 뜻하고 1은 속도결정단계에 한 종류의 분자가 관여하기 때문이고, 2는 두 종류의 분자가 관여하기 때문에 붙여진 이름입니다.
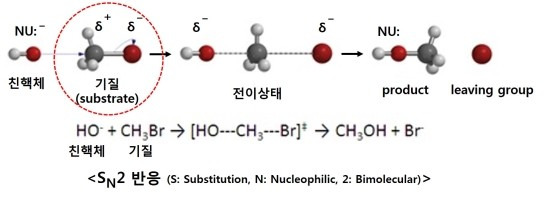
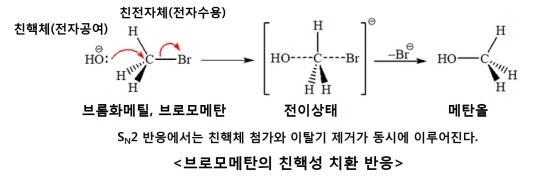
위의 그림은 브로모메탄(CH3-Br)의 SN2 친핵성치환반응으로써 그 위의 그림과 같은 원리입니다. 친핵성치환반응에서 Br−는 OH−에 비해 약한 친핵성 및 약한 염기이기 때문에 더 좋은 이탈기(good leaving group) 입니다.
SN1는 두단계를 거치며, 기질만 나타나고 반응후 라세미가 나타납니다.
SN2는 한단계를 거치기 때문에 친핵체와 기질이 동시에 중간체를 형성합니다.
SN1는 친전자체인 기질 할로젠화알킬이 3차>2차>1차 순으로 선호합니다.
SN2는 친전자체인 기질 알케인에서 메틸기>할로젠화알킬이 1차>2차>3차 순으로 선호합니다.
SN1는 친핵체의 공격에서 물처럼 중성이나 약한 친핵체의 공격을 선호합니다.
SN2는 친핵체의 공격에서 OH−, Cl−, Br−처럼 강한 친핵체의 공격을 선호합니다.
SN1는 극성 양성자성 용매에서 주로 발생합니다.
SN2는 극성 비양성자성 용매에서 주로 발생합니다.
<SN1 치환 반응>
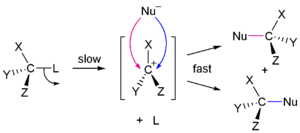
<SN1 치환 반응>
기본적으로 SN2와 SN1의 반응물은 구조적으로 큰 차이는 없지만, 가장 큰 차이점은 SN2는 치환 반응을 통해 구조 역전이 나타나고, SN1은 친핵체(- 또는 Nu-)의 결합 방식에 따라 50:50으로 좌와 우의 상관관계가 있는 2개의 라세미체가 생성됩니다. 이처럼 탄소 양이온이 삼각 평면 구조를 가지기 때문에 결과물은 R형, S형이 모두 나타나는 라세미체가 생성되어야 하지만 이온쌍의 관여에 의해 완전한 라세미화가 이루어지는 경우는 많지 않습니다.
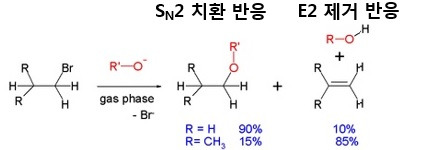
SN2 치환반응과 E2 제거반응은 경쟁적으로 발생합니다. 일차 할로젠화 알킬은 강한 염기(음이온이 친핵체가 아닌 염기로 작용함)를 사용하면 E2 제거반응이 일어납니다. 이차 할로젠화 알킬은 강한 염기를 사용하면 E2 반응이 주로 일어나지만, 극성 비양성자성 용매에서 염기성이 약한 친핵체를 사용하면 SN2 반응이 일어납니다. 위의 그림은 1차 할로겐화 알킬에서 강한 염기인 R-O−가 친핵체로 작용할지 아니면 염기로 작용할지에 따라, SN2 치환반응(친핵체로 작용)과 E2 제거반응(염기로 작용)이 경쟁적으로 나타납니다. 이렇게 음성(-) 분자는 친핵체이며 또한 염기성의 성질을 모두 가지고 있어서 스스로 경쟁하며 또한 동시에 나타납니다. 1차, 2차, 3차 알킬의 구분은 할로겐족과 바로 결합되어 있는 탄소에 붙어있는 수소가 2개면 1차, 1개면 2차, 없으면 3차가 됩니다.
■ 친핵성 아실 치환반응(nucleophilic acylsubstitution)
친핵성아실치환은 아실화합물과 친핵체를 포함시키는 치환반응의 한부류입니다. 알콜(alcohol), 아민(amine), 에놀레이드(enolate)와 같은 친핵체(-)는 산 할라이드(acid halide,할로젠화합물), 무수물(anhydride), 에스테르(ester)와 같은 아실유도체의 이탈된 그룹을 공격하며 결합하여 대체시킵니다. 생성된 생성물은 원래 존재했던 이탈기 대신에 새로운 친핵체가 결합된 카보닐(카르보닐) 함유화합물이 됩니다. 이러한 과정을 통해 다양한 생성물을 합성할 수 있습니다.
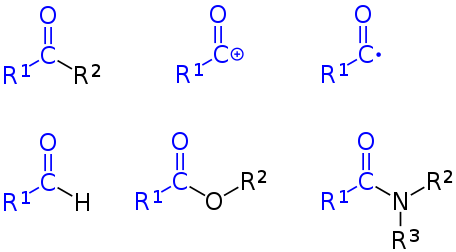
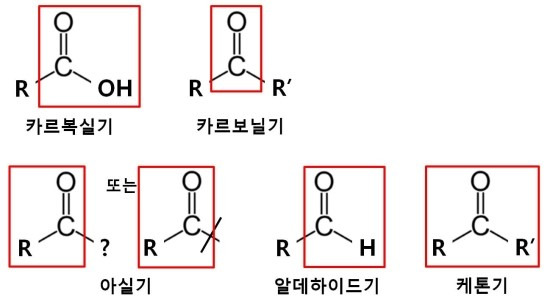
<아실기와 다양한 형태의 작용기>
<그림출처 : Acyl group - 위키백과>
아실기(친전자체)는 카복시기 R-COOH에서 OH가 제거된 잔기인 R-CO입니다. 위그림에서 파란색 부분입니다(이때 +화된 중심 탄소를 acyl cation 또는 acylium ion이라고 한다.). 아실기는 여러가지 형태의 다른 기들로 그룹을 이룰 수 있습니다. 가장 일반적인 형태인 케톤기(ketone) (top left), 아실륨이온(acylium ion) (top centre), 아실유리기(acyl radical) (top right), 알데하이드(aldehyde) (bottom left), 에스터(ester) (bottom centre), 아마이드(amide) (bottom right). (R1, R2, R3는 수소의 유기화합물치환체). 카르보닐기는 케톤기의 일종입니다.

<산성 조건>
<그림출처 : Nucleophilic acyl substitution - 위키백과>
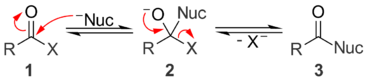
산성조건하에서 아실기의 화합물인 카르보닐기는 양성자(+)화되면서 친핵성(Z-) 공격에 의해 사면체의 중간체3을 생성합니다. 양성자가 X에 전달되어 4가 되고, 이것을 방출하여 5가 됩니다. 양성자를 배출하여 새로운 카르보닐 생성물 6을 만듭니다.
<염기성 조건>
염기성조건하에서 친핵체(-Nuc)는 아실화합물인 카르보닐기를 공격하면서 사면체 알콕시드 중간체 2를 생성합니다. 중간체는 붕괴되어 이탈그룹(X)를 방출하며 새로운 치환 생성물을 만듭니다. 이때 이탈기는 친핵체(-Nuc)보다 높은 Pka 즉, 더 강염기여야 반응이 일어납니다.
■ 친전자성 방향족 치환반응(electrophilic aromatic substitution)
방향족 고리가 있는 원자가 친전자체(electrophile)에 의해 치환되는 유기화학반응입니다. 친전자성 방향족 치환반응으로는 방향족 나이트로화 반응(aromatic nitration), 방향족 할로젠화 반응(aromatic halogenation), 방향족 설폰화 반응(aromatic sulfonation) 등이 있습니다.
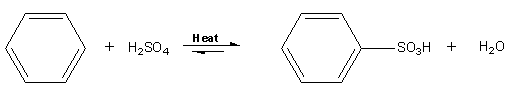
C6H6 + H2SO4 → C6H5SO3H + H2O
위의 반응은 방향족 설폰화 반응으로써, 방향족 탄화수소인 벤젠에 황산(H2SO4, sulphuric acid)을 넣고 가열하는 과정입니다. 방향족 탄화수소에 있는 수소원자가 설폰산(sulfonic acid, R-S(=O)2–OH) 작용기에 의해 치환되는 유기 반응이며, 이 반응은 친전자성 방향족 치환반응의 하나입니다. 삼산화황(sulfur trioxide, SO3) 또는 이것의 양성자화된 유도체 설폰산(sulfonic acid, SO3H)은 이 친전자성 방향족 치환에서 친전자체입니다.
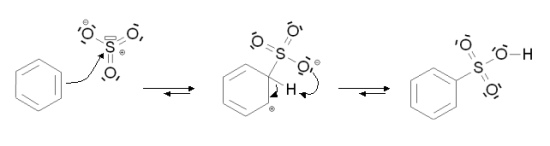
이 반응에서 삼산화황은 극성 분자로써 황 원자에 상당한 양의 양전하를 띠기 때문에 친전자체 입니다. 반면 벤젠은 비편재화된 6개의 파이전자 때문에 친핵체입니다. 벤젠은 기부할 수 있는 풍부한 전자를 가지고 있습니다.
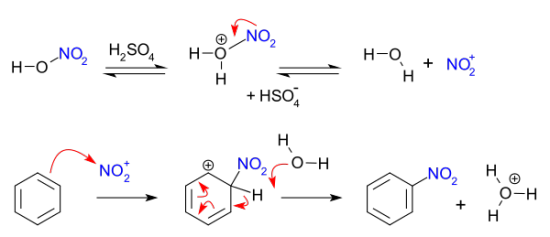
<그림출처 : 나이트로화 반응 - 위키백과>
나이트로화 반응은 유기화합물에 나이트로(-NO2) 그룹을 도입하기 위한 화학반응입니다. 위와같이 대표적인 질화 합성물은 농축 질산과 황산이 혼합된 이른바 혼산을 이용합니다. 이 혼합물은 방향족 질화에 활성종인 니트로늄 이온(NO2+)을 생성합니다. 방향족 고리의 치환기는 이러한 친전자성 방향족 치환에 영향을 미치며, 친전자체인 니트로 양이온 그룹은 벤젠의 전자를 빼내는데 효과가 있습니다. 이러한 니트로 그룹은 반응을 비활성화 시키고 친전자성 니트로늄(+) 이온이 방향족의 메타 위치를 공격하도록 지시합니다. 이 과정은 전자가 풍부한 벤젠 고리에 의한 공격을 수반하는 친전자성 방향족 치환의 한 예입니다. 친전자성 치환 반응은 대부분 벤젠에서 수소 원자가 나가며 친전자체로 치환하는 화학 반응입니다. 친전자성 방향족 치환 반응은 방향족 화합물의 특성이며, 친전자성 방향족 치환에서 친핵체로 작용하는 벤젠 고리에 작용기를 도입하는 일반적인 방법입니다. 일부 지방족 화합물도 친전자성 치환 과정을 겪을 수 있습니다.
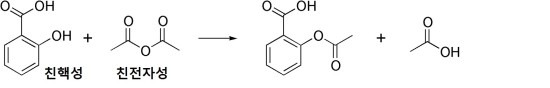
위의 과정은 살리실산(친핵성) + 무수 아세트산(친전자성) → 아세틸 살리실산(아스피린) + 아세트산의 친전자성 방향족 치환 과정입니다.
※ 첨가반응과 치환반응의 복합화
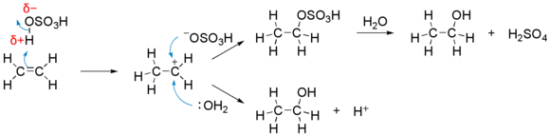
<그림출처 : Electrophile - 위키백과>
위 반응은 이중결합을 가지는 친핵체인 알켄의 수화반응(hydration, 물이 결합)입니다. 친핵체인 알켄은 H–OSO3H 분자의 δ+ 전하를 가지는 H 원자를 끌어들입니다. 이때 알켄은 H가 하나 증가하며 π전자를 재배열을 하고 carbocation의 양이온(+) 상태가 됩니다. 이때는 친전자체가 되어, 전자가 풍부한 −OSO3H과 :OH2를 끌어들입니다. 이때 반응은 이러한 각각 두가지 경우로 나뉘며, 최종적으로 에탄올이 생성됩니다. 이 반응은 첨가반응과 유사한 방식으로 발생하지만 OSO3H 그룹이 OH 그룹으로 치환되며 알코올을 형성하는 단계가 있습니다.
한편 이중결합을 가지는 어떤 화합물에서 친핵체인 알켄은 수소양이온과 결합을 하게되면, 양이온 탄소를 형성하게 되고, 이것이 친전자체가 되게 만듭니다. 주변에 있는 친핵체에 수소양이온을 주게되면, 탈양성자화되어 본래의 친핵체인 알켄의 형태로 돌아오지만, π전자의 이중결합 위치가 바뀌게 되고 이때 이성질화 반응을 통해 이성질체를 형성하게 됩니다. 이것은 알켄의 이성질화 반응이기도 합니다.
※ 아미드(아마이드, amide)와 아민(amine)은 유사한 구조이지만, 화학적인 작용은 다르다.
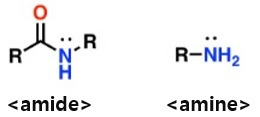
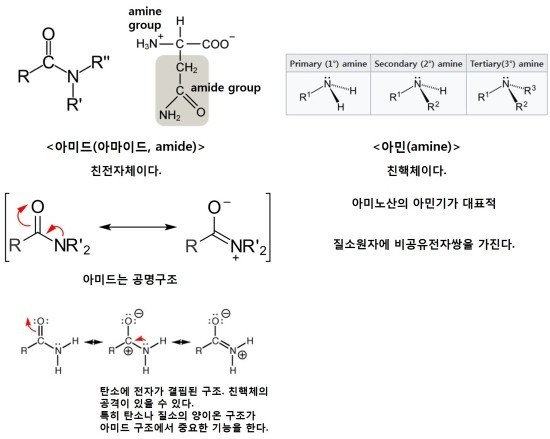
위의 그림에서 아미드는 친전자체로써 주로 작용을 하고, 아민은 친핵체로써 주로 작용을 합니다. 이것은 아미드가 공명구조로써 전기음성도가 큰 산소가 전자를 끌어당기고 따라서 순간적으로 탄소나 질소가 양이온이 되어 중간체로써 친핵체의 관심을 끌고(친핵체에게 공격 받을 수 있다.) 또한 전자쌍이 공명에 기여함으로써 상대에게 전자를 마음대로 줄 수 없습니다. 아민은 비공유전자쌍을 가지며 친전자체에게 전자를 주는 친핵제로 작용합니다. 아미드의 친전자체로써의 작용은 위에 언급되었던 친핵성 아실 치환반응과 다르지 않습니다.
이처럼 질소(N)는 그 화학 구조에 따라 친핵성을 가지거나 아니면 친전자성을 가집니다.
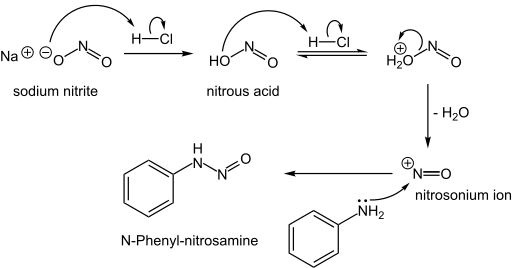
NO2− + 2 H+ → NO+ + H2O
R2NH + NO+ → R2N-NO + H+
위의 그림은 니트로사민(N-nitrosamine)의 형성으로써, N-니트로사민은 아질산염 공급원과 아미노 화합물의 반응에서 발생하며, 이는 발암성 물질로써 육류를 경화(curing, 염지)하는 동안 발생할 수 있습니다. 일반적으로 이 반응은 2차 아민(R2NH)의 친핵성 질소가 친전자성 니트로소늄 이온(NO+)의 질소를 공격할때 발생합니다. 즉, 2차 아민(R2NH)의 질소(N)는 친핵성이고, 니트로소늄 이온(NO+)의 질소(N)는 친전자성입니다. 이때 아민은 친핵성으로써 니트로소늄이온을 공격하므로 친핵성 첨가반응입니다.
니트로사민은 양성자화를 통해 물을 잃어 디아조늄 양이온을 형성할 수 있으며, 이는 다양한 화합물을 형성하는데 매우 유용한 중간체입니다.
아질산염(nitrite, NO2-)의 경우처럼, 아질산염은 물리/화학적 환경에 따라 다음과 같은 두가지 반응에 들어갈 수 있습니다. 아래의 반응은 화합물에 산화질소(NO)를 첨가하는 반응이라는 공통점이 있지만 또한 약간 다릅니다.
니트로실화(Nitrosylation)는 금속(예: 철) 또는 티올에 니트로실 이온(nitrosyl ion) NO−를 추가하여 니트로실 철 Fe-NO(예: 니트로실화된 헴 또는 니트로실헴) 또는 S-니트로소티올(RSNO)을 생성합니다. 상대가 금속이면 양성(+, 친전자체)의 성향이므로 음(NO−)으로 결합합니다.
니트로소화(Nitrosation)는 니트로소늄 이온(nitrosonium ion) NO+를 아민(–NH2)에 첨가하여 니트로사민(R2N−N=O)을 생성하는 것입니다. 이 전환은 N-페닐니트로사민 형성에 대한 반응에서 볼 수 있듯이 산성 pH, 특히 위장에서 발생합니다. 상대가 아민처럼 음성(-, 친핵체)의 성향이면 양(NO+)으로 결합합니다.
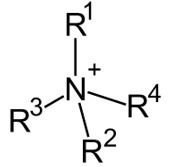
아민은 친핵성이지만, 위와 같은 4차 아민 즉, 암모늄이온은 양이온이지만 친전자성이아닙니다. 암모늄이온은 옥텟규칙을 만족하며 더이상 결합을 할 수 없기 때문에 친핵성도 친전자성도 아닙니다(반응하지 않는다.).
※ 전자가 풍부해보이는 카보닐(카르보닐, carbonyl)기는 왜 친전자체인가?
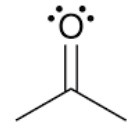
<카보닐기>
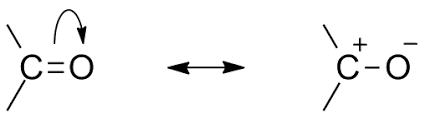
<카보닐기의 공명>
카보닐기는 중심탄소가 공명을 통해 양이온 탄소로 전환될 수 있고, 이것이 친전자체로써 친핵체의 공격을 받을 수 있습니다.
본래 전자가 풍부한 분자는 친핵체이지만, 때로는 중심분자(탄소)가 전자가 부족할때에는 친전자체가 됩니다.
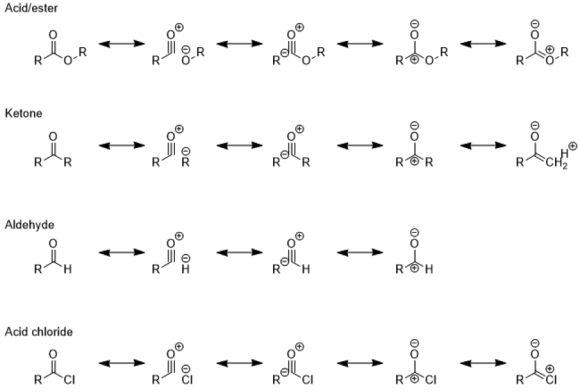
<다양한 카보닐기의 공명>
에스테르는 카르보닐 탄소에서 친핵체와 반응합니다. 카르보닐은 약한 친전자성을 갖지만 강한 친핵체(아민, 알콕사이드 등)의 공격을 받습니다. 위의 카보닐기 예를들면 에스테르, 케톤, 알데하이드 등은 중심탄소가 공명을 통해 양이온이 되므로 친전자성입니다.
또한 카르보닐기는 산소의 전기음성도가 탄소의 전기음성도보다 크기 때문에 극성입니다. 따라서 케톤은 산소에서는 친핵성이고, 탄소에서는 친전자성입니다. 그러므로 이렇게 표현합니다. "케톤은 산소에서는 친핵성이고, 탄소에서는 친전자성이다. 카르보닐 탄소는 친전자성이므로 친핵체의 공격을 받을 수 있다. 알데하이드와 케톤의 가장 일반적인 반응은 친핵성 첨가 반응으로, 친핵체(:Nu-)가 카르보닐기의 친전자성 탄소에 첨가된다."
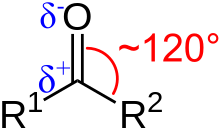
공명이 아니더라도 카르보닐 탄소는 일반적으로 친전자성입니다. 탄소의 양전하와 산소의 음전하로 인해 카르보닐기는 친핵성 공격을 받습니다. 친핵성 반응은 종종 친핵체의 염기도에 비례하며, 친핵성이 증가함에 따라 카르보닐 화합물 내의 안정성은 감소합니다. 카르보닐 탄소의 친전자성의 순서는 RCHO(알데히드) > R2CO(케톤) > RCO2R'(에스테르) > RCONH2(아미드)입니다. 다양한 친핵체가 공격하여 탄소-산소 이중 결합을 깨뜨립니다.
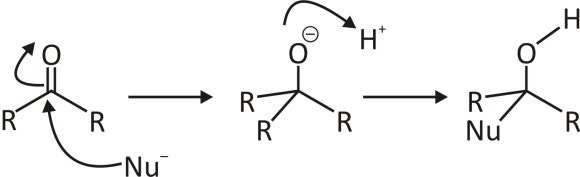
위의 반응에서 케톤의 중심탄소가 양전하 밀도가 높아서 친핵체의(Nu-)의 친핵성 공격으로 친핵성 첨가 반응을 합니다. 중간그림처럼 알콕사이드일때, 산을 첨가하게되면 알콕사이드가 양성자화되면서 알코올을 생성하게 됩니다. 양성자는 친전자성이므로, 양성자화는 친전자성 첨가의 일종입니다.