장과 뇌의 상호작용 (장-뇌 축)
장(腸)에는 우리 몸의 면역력을 좌우하는 면역세포의 70%가 존재하며 약 100종류, 100조 이상의 균이 서식하고 있다. 장내 미생물은 유익균, 유해균, 중간균으로 나뉘어 균형을 이루는데, 이 같은 장내 미생물의 균형이 깨지면 몸에 이로운 유익균 군집이 붕괴되고 해로운 균이 득세하면서 염증과 스트레스가 발생해 암이나 당뇨 등 각종 질병이 발생한다.
장에는 약 4~6억대의 뉴런이 존재한다. 이를 장 신경계(enteric nervous system)라 하며, 약 1000억 개의 뉴런으로 구성된 뇌를 제외하고 다른 부위들보다 유독 신경이 많기 때문에 소위 '제2의 뇌'라고 부르기도 한다. 장 신경계는 복잡한 소화과정을 모니터링하고 위에 들어온 음식물을 근육 수축으로 장까지 나르며 장내에 PH값을 화학 성분에 따라 유지하는 효과를 제공한다.
장 신경계는 뇌와 같은 양의 도파민을 생성하는 다양한 신경과 신경교세포 등으로 이뤄져 있다. 뇌와 비슷한 수준인 40종에 달하는 신경 전달 물질을 합성하고 체내에 있는 행복 호르몬인 세로토닌 중 95%는 항상 장 신경계에 축적되어 있다. 세로토닌은 사람의 뇌 속에서 수용체와 결합해 우울증, 불안감을 조절하지만, 분비량이 적거나 붙어 있어야 하는 수용체에서 빨리 소실되면 ‘세로토닌 수용체 밀도’가 낮아지기 때문에 우울증, 강박장애가 나타날 수 있다. 또한 장내 세균 중 유해세균의 비율이 높은 상태가 지속되면 음식물이 부패하면서 유발되는 인돌, 스카톨, 페놀 등 400여 가지의 독성물질의 영향으로 DNA 메틸화에 의하여 뇌의 기능적 이상이 유발된다. 정신질환을 치료하려면 소화기 문제를 해결함이 우선인 셈이다.

장과 뇌의 상호작용 (장-뇌 축)
Gut-Brain Axis, GBA
장-뇌 축은 위장관과 중추신경계 사이에서 일어나는 생화학적 신호 전달이다. 그 기간은 상호 작용에 있는 장내세균총의 역할을 포함하기 위하여 확장되었으며, microbiome-gut-brain axis(MGBA)라는 용어는 종종 장내세균총을 포함한 패러다임을 기술하기 위해 사용된다. GBA(Gut-Brain Axis)는 중추신경계와 자신경계 사이 양방향 통신으로 이루어져 뇌의 정서적 및 인지적 센터와 말초 장기능을 연결한다. 최근 연구의 진보는 이러한 상호작용에 영향을 미치는 소화관 마이크로바이옴의 중요성을 설명한다. 미생물과 GBA 사이의 상호 작용은 양방향, 즉 장내미생물 군에서 뇌로, 뇌에서 소화관 내로 신호 전달을 통해 신경, 내분비선, 면역 및 체액 연결을 통해 나타난다.

장투과성으로 인해 생긴 면역계의 이상은 여러가지 cytokine들을 분비해서 뇌에 영향을 줄 수 있고 스트레스받은 뇌는 시상하부-뇌하수체-부신으로 이어지는 축(HPA axis)을 발동시켜서 스테로이드 관련 반응을 야기하며, 자율신경(ANS)을 통해 장운동이나 장 분비액을 조절하고 장내에서 분비된 세로토닌 등은 뇌에 다시 영향을 준다. 이로써 장내 세균이 만든 여러 대사물들이 서로 영향을 주는 것이다. 우리가 스트레스나 부정적 감정을 갖게 되면, 뇌는 스트레스 호르몬을 방출하고 이 호르몬이 장에 전달되어 미생물들에게 부정적인 영향을 준다. 기분이 나빠진 미생물들은 나쁜 호르몬을 내고, 이 호르몬이 장에 악영향을 주게 되어 결국 대뇌변연계에서 부정적인 감정을 갖도록 한다. 그야말로 악순환이 이루어지는 것이다. 사회생활을 하는 우리는 자신도 어쩔 수 없는 스트레스 환경에서 노출되어 있기 때문에 이러한 악순환이 생기기가 쉽다.
최근 뇌 연구에서 장과 뇌는 직접적인 의사소통을 하는 것으로 알려져있는데, 대표적인 긍정적 연구결과로는 애리조나주립대 연구팀이 2017년에 발표한 대변 미생물 이식에 대한 임상시험 결과다.
연구팀은 6~17살의 자폐 환자 18명을 모집하여 이들을 대상으로 마이크로바이옴 이식을 시행했다. 건강한 사람의 대변에서 모은 이식용 미생물 군집은 환자에게 주입하기 전에 철저하게 병원균의 존재 여부를 확인하는 과정을 거쳤다. 확실한 생태계 복원을 위해 연구진은 18주에 걸쳐 여섯 차례의 장내 미생물 이식을 반복해서 수행했다. 이식 뒤 환자의 장은 원래 있었던 미생물은 대부분 사라지고, 대신 이식한 미생물로 바뀌어 있음을 미생물 유전자 검사를 통해 확인할 수 있었다. 그 결과 정상인 수준의 종 다양성을 갖춘 균형 잡힌 생태계가 복원되었음은 물론이다.
그렇다면 환자들의 증상은 어떻게 되었을까? 자폐 환자에게 있던 고질적인 변비, 설사, 복통 등의 장질환은 18명 중 16명에게서 80% 이상 크게 개선되었다. 물론 더 관심이 쏠린 부분은 자폐 증상의 완화 여부이다. 환자의 부모와 의사에 의해 각각 측정된 다양한 자폐 관련 증상을 취합 분석한 결과, 평균 25% 정도 자폐 증상의 호전이 나타났다. 이 연구는 극히 적은 환자에 대해서 이루어졌으며 일반적인 임상연구에 필수인 위약군도 포함되지 않았다. 이런 한계에도 실험동물을 대상으로 수행된 많은 연구에서 나타난 장내 미생물과 자폐의 인과관계 그리고 이를 이용한 치료 가능성을 확인해 주었다는 점은 분명하다. 대변 미생물 이식 임상시험이 끝난 2년 뒤까지도 특별한 추가 조처 없이 당시 참가했던 자폐아 18명의 증상이 다시 악화하지 않고 장내 미생물 생태계의 균형도 잘 유지되고 있다는 것은 매우 고무적인 일이 아닐 수 없다.
장내 미생물과 뇌질환 사이를 연결하는 고리의 전체가 완전히 다 밝혀지지는 않았지만, 분명히 중요한 역할을 하는 건 바로 우리 면역계이다. 미생물이 장에 있는 면역세포를 조절하고 그 결과로 뇌에 이상이 생긴다는 가설이다. 세계의 수많은 연구자가 경쟁하는 가운데 최근에 이 가설을 증명할 결정적인 연구결과를 발표한 연구자는 한국인 면역학자 허준렬 하버드대 교수다. 허 교수는 임신한 생쥐가 특정 바이러스에 감염되면 자식에게 자폐 증상이 나타나는 현상을 이용했다. 바이러스에 감염된 어미 생쥐에게는 염증을 일으키는 ‘티에이치17’(Th17)이라는 면역세포가 만들어지고 이로 인해 새끼의 뇌에 자폐 증상이 나타나는 변화가 생긴다. 이 실험 모델을 이용해서 질병을 일으키는 또 다른 중요한 방아쇠를 발견했다. 바로 장내 미생물이다.
소화기관 장내 미생물이 자폐증을 유발하는 면역세포 생성에 영향
연구팀이 찾은 세균은 절편섬유상세균(SFB)으로 불리는 종인데, 이전까지 거의 알려진 적이 없어 학명조차 없는 미지의 미생물이다. 만약에 이 세균이 장에서 염증을 일으키는 티에이치17 면역세포의 수를 늘리는 역할을 한다면, 반대로 이 세균을 없애면 새끼에게 자폐 발생이 줄어들까? 연구팀이 반코마이신이라는 항생제를 어미 쥐에게 먹여 절편섬유상세균을 장에서 제거하자 실제로 새끼에게서 자폐 증상이 사라지는 것이 확인됐다.
장내미생물의 분비물(대사산물)이 면역세포를 자극해 뇌에 영향을 주는 신호분자인 사이토카인을 분비하도록 하는 데에도 관여한다는 연구도 보고되고 있다. 장내 미생물의 영향을 받는 장 내 환경이 우울, 불안, 자폐증상 같은 정신건강 상태와 연관된다는 연구도 꾸준히 이어지고 있다. 장내 세균과 인체 내 세균들을 분석하여 각종 질병 예측과 치료 연구를 수행하는 한국의 과학연구원에서는 휴먼 마이크로바이옴(Human Microbiome)과 휴먼 위장관 메타게놈(MetaHIT: Metagenomics of the Human Intestinal Tract) 등 인체에 존재하는 미생물을 분석해 각종 질병의 원리를 파악하고 근본적인 치료와 예방 기술을 연구한다. 치매, 루게릭병, 암 등 아직도 제대로 된 치료제가 없는 병들도 많고 왜 병에 걸리는지 그 이유조차 불분명한 질병도 많다. 이러한 병들로부터 치료되기 위해서 기초가 되는 생명공학연구를 한국의 과학연구원에서 수행하고 있다. 연구원은 특히 장과 뇌의 연결고리에 주목하고 자폐와 같은 정신질환에 장내 세균과의 연관성을 찾는데 장내 세균분석(GMA), 차세대염기서열분석(NGS) 등을 활용하여 연구에 집중하고 있으며, 앞으로도 뇌기능과 정신건강을 향상하기 위안 장내 미생물의 활용방법에 대해 계속해서 연구가 필요할 것이다.
Gut Brain Axis (GBA)
Introduction

One of the most cutting-edge areas of research involves the gut-brain axis (GBA) ie the connection between the brain, gut, and microbiome and its potentially huge influence over our health.
Our gut and brain are closely connected. They communicate with each other through the GBA, a bidirectional link between the central nervous system and the enteric nervous system (ENS) of the body. The ENS is a web of sensory neurons, motor neurons, and interneurons embedded in the wall of the gastrointesinal system, stretching from the lower third of the esophagus right through to the rectum. It links, via direct and indirect pathways, cognitive and emotional centres in the brain, with peripheral intestinal functions.
The GBA involves complex crosstalk with the brain sending messages to the gut and vice versa.
This interaction occurs between the endocrine (hypothalamic-pituitary-adrenal axis), immune (cytokine and chemokines) and the autonomic nervous systems (ANS)[1].
Plays a role in irritable bowel syndrome, celiac disease, and colitis.
Stress signals from the brain can influence digestion through this axis, and the gut can also send signals that similarly influence the brain. Gut microbes appear to play a key role in sending and receiving these signals.
The exponential growth of evidence detailing the bidirectional interactions between the gut microbiome and the brain supports a comprehensive model that integrates the central nervous, gastrointestinal, and immune systems with this newly discovered organ[2].
Gut Microbiota
Gut microbiota is an assortment of microorganisms inhabiting the length and width of the mammalian gastrointestinal tract. The composition of this microbial community is host specific, evolving throughout an individual's lifetime and susceptible to both exogenous and endogenous modifications. A newborn is first exposed to the mother’s vaginal microbiota which influences the offsprings microbial signature. Studies show that the gut microbiota is central to the development and maturation of the human CNS and ENS in these early postnatal weeks.[1]
Estimates of the number of bacterial species present in the human gut vary widely between different studies, but it has been generally accepted that it contains ∼500 to 1,000 species.
It is estimated that the human microbiota is 10 times greater than the number of human cells present in our bodies. The microbiota colonizes virtually every surface of the human body that is exposed to the external environment eg on our skin and in the genitourinary, gastrointestinal, and respiratory tracts. The most heavily colonized organ is the gastrointestinal tract (GIT); the colon is estimated to contain over 70% of all the microbes in the human body.
The human gut has an estimated surface area of a tennis court (200 m2) and, as such a large organ, represents a major surface for microbial colonization and the GIT is rich in molecules that can be used as nutrients by microbes, making it a preferred site for colonization.
The overall balance in the composition of the gut microbial community, as well as the presence or absence of key species capable of effecting specific responses, is important in ensuring homeostasis or lack thereof at the intestinal mucosa and beyond.
The majority of the gut microbiota is composed of strict anaerobes, which dominate the facultative anaerobes and aerobes by two to three orders of magnitude. There have been over 50 bacterial phyla described to date with the human gut microbiota being dominated by only 2 of them: the Bacteroidetes and the Firmicutes[3].
Production of Microbial Metabolites: Many species of Lactobacillus and Bifidobacterium produce gamma-aminobutyric acid (GABA), which is the main inhibitory neurotransmitter in the brain. Other bacteria have been shown to produce the neurotransmitters serotonin and dopamine. Bacteria also produce short-chain fatty acid that are able to stimulate sympathetic nervous system, mucosal serotonin release and thus influence the memory and learning process in the brain[4].
Gut microbiota can regulate host tryptophan levels, which is a main serotonin precursor. Peripherally, serotonin is involved in the regulation of GI secretion, motility (smooth muscle contraction and relaxation), and pain perception, whereas in the brain serotonin is implicated in regulating mood and cognition[5]. A dysfunctional serotonergic system is considered to be one of the main factors contributing to the development of depression (approximately 95% of Serotonin is produced by cells in the gut mucosal).
The Gut Brain Link
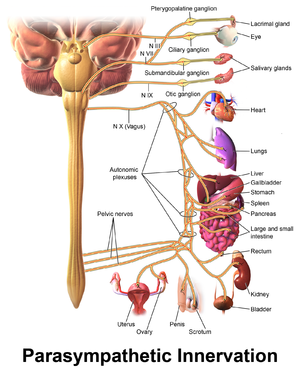
The gut and the brain links:
The gastrointestinal tract is connected to the brain through the Vagus nerve. The vagus nerve links the heart, gastrointestinal tract, and lungs to the brain (like a cable that links the heart, gastrointestinal tract and lungs to the brain). Sensory neurons carry feedback from the intestinal end to the brain stem which then engages the hypothalamus (which is a brain region that controls hunger and emotions) and limbic system (the emotional nervous system). Similarly, descending projections from the limbic system (activated via stress) influence autonomic activity of the gut.
Bacterial products stimulate neuroendocrine (gut hormone) signalling. Neuropeptides are the most diverse class of signaling molecules in the brain engaged in many physiological functions). These neuropeptides then enter the bloodstream and/or directly influence the enteric nervous system.
The gut associated lymphoid tissue comprises 70% of the body’s immune system and can be conceptualised as the largest immune organ in the body.
Health Implications

The gut-brain axis refers to the two-way connection and communication between the gut and the brain. What is happening in the gut can directly influence our brain function and behaviour.
A correct communication between the gut bacteria and the brain is important in order to have adequate mental health. The GBA makes this communication possible. Scientists are still trying to understand exactly how this axis works. However, it is clear that there is an association between a healthy brain and the GBA.
Diet is probably the most important strategy for maintaining a healthy GBA. A balanced diet, including fish, vegetables, cereals, fruits, and water is important to keep both a functional GBA and a good mood. The food that we consume has a direct impact on our bacteria and their home, our bodies[6].
Patients suffering from depression may benefit from this research on the GBA. These patients might be able to improve their condition by eating a healthy diet. Our habits, such as diet, definitely influence our moods, so we should take care with our diets. Eat well and be happy!
Changes in the GBA, caused by things like stress, can lead to digestive conditions such as IBS. This is due to activation of the body’s fight-or-flight response and changes in the gut microbiota.
Autism, a neurodevelopmental disorder, is characterized by a high level of social interaction insufficiency, impairment in language, and repetitive behavior. The gut–brain axis (GBA) is considered a bidirectional communication pathway between the gut and the brain. Growing evidence shows that the GBA contributes to the etiology of autism. The phenotypic behaviors of autism and the gastrointestinal problems that are comorbidity in autism are associated with modified gut microbiota[7]. See Image
Dysbiosis in the gut microbiome is a direct factor that influences the GBA’ normal functioning and leads to mental health conditions like depression and anxiety.
Data from preclinical and clinical studies have shown remarkable potential for novel treatment targets not only in functional gastrointestinal disorders but in a wide range of psychiatric and neurologic disorders, including Parkinson's disease, autism spectrum disorders, anxiety, and depression, among many others[2]
References
- ↑ Jump up to:1.0 1.1 Psyche Scene hub The Simplified Guide to the Gut-Brain Axis – How the Gut and The Brain Talk to Each Other Available from:https://psychscenehub.com/psychinsights/the-simplified-guide-to-the-gut-brain-axis/ (accessed 2.2.2021)
- ↑ Jump up to:2.0 2.1 Martin CR, Osadchiy V, Kalani A, Mayer EA. The brain-gut-microbiome axis. Cellular and molecular gastroenterology and hepatology. 2018 Jan 1;6(2):133-48.Available from:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6047317/ (accessed 2.2.2021)
- ↑ Sekirov I, Russell SL, Antunes LC, Finlay BB. Gut microbiota in health and disease. Physiological reviews. 2010 Jul 1.Available from: https://journals.physiology.org/doi/full/10.1152/physrev.00045.2009?rfr_dat=cr_pub++0pubmed&url_ver=Z39.88-2003&rfr_id=ori%3Arid%3Acrossref.org (accessed 2.2.2021)
- ↑ Diet vs disease The Gut-Brain Axis Explained in Plain English Available from:https://www.dietvsdisease.org/gut-brain-axis/ (accessed 2.2.2021)
- ↑ Lukić I, Getselter D, Koren O, Elliott E. Role of tryptophan in microbiota-induced depressive-like behavior: evidence from tryptophan depletion study. Frontiers in behavioral neuroscience. 2019 Jun 4;13:123 Available from:.https://www.frontiersin.org/articles/10.3389/fnbeh.2019.00123/full#h2 (accessed 3.2.2021)
- ↑ Frontiers Happy Gut Bacteria, Happy Brain: The Microbiota-Gut-Brain Axis Available fromhttps://kids.frontiersin.org/article/10.3389/frym.2019.00015 (accessed 3.2.2021)
- ↑ El-Ansary A, Bhat RS. Targeting gut microbiota as a possible therapeutic intervention in autism. InAutism 360° 2020 Jan 1 (pp. 301-327). Academic Press.AVAILABLE FROM:https://www.sciencedirect.com/science/article/pii/B9780128184660000174 (accessed 3.2.2021)
장-뇌 축이론
장 건강이 뇌 건강을 좌우
장 내 미생물 연관성을 실험에서 조현병(망상, 환각, 환청, 현실과의 괴리감)도 장내 건강과 관련성이 있다는 사실을 규명
장뇌 축 가설은 장과 뇌는 직통 연결 라인으로 이어져 있어 ‘장과 뇌가 직접 신호를 주고받는다’는 이론이다.
근래에 들어 뇌 치료의 핵심은 장을 건강하게 하는 것과 밀접한 관련이 있다는 이론이 큰 반향을 불러일으키고 있다.
다수의 의학 전문가들은 장을 치료하면 뇌가 건강해진다고 주장한다.
장 내 면역 체계에 문제가 생기면 이는 뇌 질환을 유발하는 원인이 된다는 이론이 의학계 내에서 과학적인 사실로 받아들여지고 있는 추세다.
우리 몸에서 신경세포의 분포도가 가장 높은 곳 1위가 뇌고, 그다음은 장이다. 그래서 장은 제2의 뇌라고도 불린다. 게다가 미추신경 신호의 빈도는 장:뇌가 9:1로 장 내에서 뇌로 보내는 신호가 훨씬 더 활발하다.
흔히 뇌에서 분비된다고 알려져 있는 행복호르몬이라 불리는 세로토닌이 가장 많이 분비되는 곳은 뇌가 아닌 장이다. 장에서 90% 이상이 분비된다고 한다.
건강한 장은 선택적 장벽이 튼튼하다. 선택적 장벽이란 영양소는 흡수하고 염증이나 독소는 혈관 속으로 투과되지 않도록 방어하는 것이다.
유전적 요인이나 각종 가공 음식, 유전자 변이식품, 알레르기유발식품, 음주, 흡연 등에 의해 염증이 유발되어 장벽이 느슨하게 되는 장누수가 생기면 느슨해진 틈으로 유해 물질이 타고 들어와서 혈관으로 유입되어 전신으로 운반된다.
잘못된 식습관으로 인해 독소와 염증이 발생하고 장벽의 느슨한 틈으로 유입된 독소가 혈관을 타고 뇌혈관을 손상시키는 것이다.
치매, 파킨슨, 자폐증 환자의 절반 이상이 장 질환을 가지고 있다는 사실이 발표되어 장의 상태가 뇌에 미치는 직접적인 영향이 증명되었다.
2017년 하버드대 허준렬 교수와 MIT, 글리리아 최교수는 부부 공동 연구로 국제적인 학술지 Nature지에 발표한 논문에서 이와 같은 사실을 증명하였다.
임신한 어미 쥐의 장내 미생물을 불균형 상태로 유도했을 때 태어난 아기 쥐에게서 자폐 증상이 관찰되었다. 반대로 어미 쥐의 장내 세균을 제거했을 때 다시 태어난 아기 쥐에게서 는 자폐 증상이 관찰되지 않았다.
독소가 혈액을 타고 피부로 가면 두드러기. 아토피 등 만성 피부 질환을 유발하고 뇌로 가면 뇌의 전두엽이 손상되면 ADHD(주의력결핍장애)를 일으킬 수 있다.
뇌의 심부 기저핵에 손상을 주면 파킨슨, 사경증, 근긴장이상 증 등이 나타나고 자율신경계에 문제를 일으키면 불안, 강박 두통 등을 불러온다.
건강한 사람의 대변 속에서 유익균 미생물을 채취해서 2년 간 이식한 실험에서 위장 장애는 58%가 줄었고, 자폐 증상은 50%가 개선되었다는 놀라운 결과가 보고 되었다.
장 누수증으로 인해 장벽을 투과한 염증과 독소가 뇌혈관 보호 장벽을 뚫고 들어가 뇌에 염증이 유발된 경우에는 뇌 건강에 아무리 좋은 치료와 음식을 먹고 운동을 병행해도 염증의 원인이 되는 장 건강을 개선하지 않으면 치료 효과를 기대하기는 어렵다.
미국애리조나주립대학교 연구팀은 장 내 미생물의 차이가 뇌 질환의 일종인 자폐증에 영향을 미친다는 연구 결과를 보고하였다.
자폐아의 장 내에는 섬유질이 부족하고 프로보테라와 같은 장내 유익균 수가 적다는 것을 알아냈다
캘리포니아 공대 사르키스 아즈마니안 교수팀은 파킨슨병과 장 내 미생물의 연관성을 실험 관찰하여 조현병(망상, 환각, 환청, 현실과의 괴리감)도 장내 건강과 관련성이 있다는 사실을 규명했다.
치매에 걸리기 쉬운 AD 쥐를 만들어 정상 쥐와 다른 미생물 생태계를 확인한 결과 치매 관련 단백질 발견하였다. AD쥐들에게 4개월간 정상 쥐의 미생물을 이식한 결과 치매 관련 단백질 증가 속도가 감소되는 결과를 얻어 치매 발생 속도를 늦추고 치료에 대한 기대감을 불러일으켰다.
장 건강은 현대인의 비만과도 밀접한 연관이 있다. 가공식품을 자주 먹는 것은 장내 미생물 생태계(마이크로옴)의 불균형을 초래한다.
특히 가공된 곡류와 밀을 주원료로 만든 떡, 빵, 과자, 라면 등 밀가루 음식과 햄, 소시지, 통조림 등 육가공 식품들은 장 내 미생물의 먹이가 되는 섬유소가 절대적으로 부족하여 배고픈 미생물들이 장점막을 갉아먹게 만드는 원인이 될 수 있다.
다이어트 균으로 체내 염증을 감소시키는 것으로 알려진 프리보텔라라는 이름의 균은 식이섬유가 풍부한 음식을 먹이로 이용한다.
장내 유익균은 지방을 짧은 지방산으로 분해하여 장을 보호하고 면역 체계를 안정화시켜주며 포만감을 느끼는 호르몬 분비를 촉진하여 비만을 억제하는 효과가 있다.
장(腸) 건강이 뇌 건강
'장뇌 축' 작동 메커니즘 확인
뇌 시상하부 뉴런, 장 세균 변화 직접 감지→식욕, 체온 조절
장 세균 세포에서 떨어진 NOD 2 수용체, 매개 물질 역할
프랑스 파스퇴르 연구소, 저널 '사이언스'에 논문
'장뇌 축'의 작동 메커니즘
'
장(腸)의 미생물(gut microbiota) 세포에서 떨어진 부산물은 혈액을 타고 순환하면서 면역, 물질대사, 뇌 기능 등을 조절하는 거로 알려졌다.
장과 뇌 사이에 신호 전달 경로가 존재한다는 '장뇌 축'(gut-brain axis) 이론이다.
그런데 과학자들은 지금까지 이 이론을 입증할 만큼 명백한 근거를 제시하지 못했다.
'장뇌 축'이 실제로 어떻게 작동하지도 설명할 수 없었다.
마침내 프랑스 과학자들이 뇌와 장 미생물 사이의 신호 교환 메커니즘을 밝혀냈다.
장 생태계에 변화가 생기면 뇌의 시상하부 뉴런이 곧바로 이를 감지해 식욕, 체온 등을 조절한다는 게 요지다.
비유하자면 뇌가 장 세균과 직접 의사를 소통한다는 뜻이다.
이 발견은 장차 비만, 당뇨 등의 대사 질환을 퇴치하는 획기적인 치료법 개발로 이어질 수 있다.
파스퇴르 연구소 과학자들이 주도한 이 연구엔 프랑스의 국립 보건의료연구소(Inserm)와 국립 과학연구원(CNRS) 과학자들도 참여했다.
관련 논문은 최근 저널 '사이언스'(Science)에 실렸다.
장은 인체 내에서 가장 큰 세균 저장소다.
한마디로 인간과 장 세균은 서로 의존하는 관계다. 장 세균은 숙주인 인간에 기생하면서 소화 작용 등을 돕는다.
이른바 '장뇌 축' 이론은 이런 상호의존 관계가 훨씬 더 깊다고 주장한다.
장의 미생물 총(叢)이 장 신경망이나 뇌에 직접 영향을 주거나 반대로 뇌의 활성도가 면역세포를 통해 장 미생물에 영향을 미친다는 것이다.
실제로 세로토닌 같은 매개 물질은 혈류를 타고 장과 뇌 사이를 오가면서 빠르게 신호를 전달한다.
이번 연구는 뇌와 장 사이에서 이런 연결축이 실제로 작동한다는 걸 입증했다.
'장이 튼튼해야 뇌도 건강해진다'라는 주장에 충분한 근거가 있는 걸 보여준 셈이다.
파스퇴르 연구팀이 초점을 맞춘 건 보통 면역세포 내에 존재하는 NOD 2라는 수용체다.
NOD를 풀이하면 '뉴클레오타이드 저 중합체화 도메인'(nucleotide oligomerization domain)이란 뜻이 된다.
이 수용체는 세균의 세포벽 구성 요소 중 하나인 펩티도글리칸(peptidoglycan)을 감지한다. 펩티도글리칸은 다당류에 짧은 펩타이드 고리가 결합한 걸 말한다.
NOD 2 수용체 코드를 가진 유전자의 돌연변이가 크론병, 감정 장애(mood disorders), 소화불량 등과 연관돼 있다는 건 이미 알려진 상태였다.
하지만 이 정도론 뇌와 장의 직접적 상관관계를 입증하기 어려웠다.
연구팀은 생쥐 모델의 뇌를 fMRI(기능적 자기 공명 영상법) 같은 영상 기술로 관찰했다.
NOD 2는 뇌의 여러 영역에 존재했다. 하지만 특히 시상하부에 많았다.
그런데 장에서 혈류를 타고 온 펩티도글리칸과 접촉하면 NOD 2가 있는 시상하부 뉴런의 전기적 활성이 억제됐다.
반대로 시상하부 뉴런에 NOD 2가 발현하지 않을 경우 펩티도글리칸과 접촉해도 전기 활동이 둔화하지 않았다.
NOD 2가 없는 생쥐는 뇌가 음식 섭취와 체온을 제대로 조절하지 못해 체중이 증가했다.
이런 생쥐는 2형 당뇨병에 걸릴 위험이 커졌는데 특히 나이 든 암컷이 더 위험했다.
장과 혈액, 뇌 등에 펩티도글리칸이 존재한다는 건 장 세균의 급격한 증식을 알리는 생물지표라고 과학자들은 지적했다.
뇌의 시상하부 뉴런이 장 세균의 세포막에서 떨어진 펩티도글리칸을 직접 감지한다는 건 놀라운 일이었다.
특히 시상하부가 체온, 시장기, 갈증, 생식 기능 등을 조절하는 뇌의 핵심 중추라는 점에서 더 그랬다.
과학자들은 면역세포가 이런 기능을 하는 걸로 알았는데 알고 보니 뇌가 직접 했다.
뇌는 장 세균의 증식, 사멸 등을 감지해 음식물 섭취가 장의 생태계에 어느 정도 충격을 주는지 곧바로 알아냈다.
파스퇴르 연구소의 '미세환경 면역 유닛(unit)' 책임자인 제라 에벨 박사는 "어떤 음식을 너무 많이 먹으면 장에서 특정 병원체나 세균의 성장만 자극해 전체 미생물 총의 균형을 위협할 수 있다"라고 조언했다.
하지만 연구 결과를 실제로 임상에 적용하려면 아직 연구할 게 많다.
특히 뇌과학, 면역학, 미생물학 등 여러 분야의 공동 연구가 필요하다고 한다.
이런 학제 간(interdisciplinary) 연구가 충실히 진행되면 뇌 질환, 당뇨병, 비만 등의 새로운 치료법이 개발될 거로 과학자들은 기대한다.