색(色), 색깔, 빛깔
색각으로 느낀 빛의 주파수(또는 파장)의 차이에 따라 다르게 느껴지는 색상들을 말한다. 갈색, 고동색과 같이 서로 다른 색상들에 대해 붙인 이름들을 말하기도 한다. 한편 물체에 색을 칠하는 행위를 도색이라고 한다.
주요 속성
특정한 색을 나타내는 주요 속성으로는 색상, 채도, 명도가 있다. 색상은 빛의 파장과 밀접한 관련을 갖는다. 채도는 빛의 선명도를 나타내는 지표이다. 명도는 빛의 밝기를 나타내는 지표이다.
물질의 색
주변에서 공기·물·유리 등과 같은 색이 없는 것을 헤아려 보면 별로 많지 않음을 알게 될 것이다. 우리 주변은 색이 없는 것이 없다고 해도 과언이 아닐 만큼 천연 또는 인공적인 다양한 색채로 장식되어 있다. 본래 색은 자연적인 것이고, 자연현상에 관련된 것이었다. 우리가 보통 사용하고 있는 원색·천연색이라고 하는 말이 이것을 뒷받침해 주고 있다. 그러나 오늘날에는 여러 가지 염료나 안료를 써서 도장이나 인쇄에 의해 재료를 마음대로 착색함으로써 이러한 색의 세계를 인공적으로 조작하고 있는 것이다. 인간은 자연계로부터 채색이라고 하는 마법을 배우고, 이것을 이용하여 그들의 생활을 풍요롭게 하고 있다. 그 마법의 근원은 도대체 무엇인가. 실은 이것도 색이 나타나는 원인을 분자의 레벨에서 고찰해 보면, 그 분자를 구성하고 있는 원자의 결합력을 조절함으로써 색이 생겨난다는 사실을 알 수가 있다.
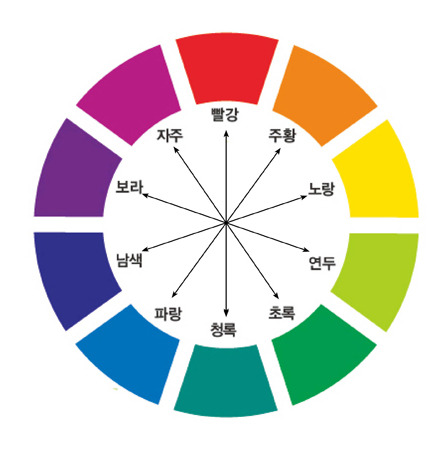
10색상환
색을 말로 표현하는 색의 언어는 색을 전달하는 데 부족함이 있는데, 이러한 어려움을 해결해 준 것이 색체계이다. 색체계의 발달로 색을 기호화하여 정확하게 정보로 저장할 수 있으며 필요에 의해 재생, 활용하는 것이 쉬워졌다.
대표적인 색체계로는 한국, 일본, 미국 등에서 표준 체계로서 채택하고 있는 먼셀(Mumsell) 표색계, 유럽에서 표준 체계였던 오스트발트(OStwald) 표색계, 최근 스웨덴을 중심으로 세계적으로 보급되고 있는 NCS(Natural Color System) 표색계, 그리고 빛의 색을 판별하고 체계화한 CIE 표준 표색계가 있다.
먼셀 표색계는 독일의 물리학자 헬름홀츠(Hermann von Helmholtz)의 지각 이론에 근거한 것으로 색의 지각적인 면에 관심을 가지고 과학적 표준화를 이루었으며 1924년에 먼셀 색표집이 처음 발간되었다. 현재 사용되고 있는 것은 수정 먼셀 표색계로 1943년 미국광학회에 의해 보완된 것이다. 우리나라에서도 KS공업규격으로 먼셀 표색계를 받아들여 활용하고 있다. 먼셀 표색계는 실제로 사용되는 모든 색이 색입체 안에 포함되도록 구성되었으며, 모든 색을 시지각적인 면에서 균등한 등간격을 이루도록 배치하였다.
색상, 명도, 채도의 3가지 속성으로 색을 표현하였고, 색상환의 기본 색은빨강(R), 노랑(Y), 초록(G), 파랑(B), 보라(P)이며, 주황(YR), 연두(GY), 청록(BG), 청보라(PB), 붉은 보라(RP)의 다섯가지 중간색을 더한 10가지 색을 기본으로 하였다. 이것을 먼셀의 10색상환이라고 한다.
각각의 색들은 다시 사이를 10단계로 구분하고, 그 각각의 구분색들은 1부터 10의 기호를 붙여 명명하였다. 이때 각 5번을 가지는 색(예를 들어 5R, 5Y 등) 이 중심색이 된다. 결과적으로 표색계를 구성하는 색상은 총 100색상이 되나, 현재는 기본 10색을 4단계로 구분한 40색상을 더 많이 사용하고 있다.
먼셀 값은 색을 색표로 표시하는 동시에 3속성의 기호로 표기하는 방법이다. 색상(H), 명도(V), 채도(C) 의 기호 표기를 순서대로 늘어놓아 ‘H V/C'와 같이 나타낸다. 예를 들어 순색 빨강이라면 ’5R 5/14'와 같이 표기하고 ‘5알 5의 14’라고 읽는다.
자연에 존재하는 색소
천연색소는 카로티노이드 색소·키논형 색소·인디고형 색소·피리미딘유도체·폴리피린계 색소·안토시아닌계 색소·플라본계 색소와 같은 몇 가지 유형으로 나눌 수 있다.
안토시아닌계 색소
꽃잎에 작용한 안토시아닌. 팬지
꽃의 색, 특히 청색이나 적색 또는 자색이나 과실의 색은 안토시아닌계의 색소인 것이 많다. 또 재미있는 사실은 이들 색소는 pH로써 그 색을 구분할 수 있다는 점이다. 예를 들면 산성에서는 적색, 중성에서는 자색, 알칼리성에서는 청색이다. 그러나 세포 내의 pH는 3.5∼5.5 범위이므로 알칼리성을 나타내는 것이 없으므로 시험관 내에서와 같은 변화는 볼 수 없다. 달구지국화 등의 청색의 본체는 안토시아닌분자와 금속원자를 주성분으로 하는 유기금속착체라고 한다.
플라본계 색소
식물에 널리 존재하는 황색의 색소로, 앵초 및 그 밖의 꽃이나 밀감류의 열매를 비롯하여 야채 등에도 함유되어 있다. 이 색소는 〔그림〕-1에서 보는 바와 같은 분자가 골격을 이루고 있고, 여기에 당이 결합한 글리콕시드의 형 또는 탄닌산에스테르의 형태로 존재하고 있다.
카로티노이드 색소
당근이나 토마토의 적색 색소로, 긴 불포화결합을 가진 분자이다. 이것은 향유(香油)의 성분인 테르펜류나 비타민A 등과 아주 비슷한 구조를 하고 있다. 사실 카로티노이드의 일종인 카로틴은 동물의 생체 내에서 비타민A로 변화한다. 또 카로틴의 일종인 β-카로틴은 산화하면 제비꽃과 같은 냄새가 난다는 사실도 알려져 있다. 식물이 만들어 내는 비슷한 구조를 가진 물질들이 제각기 향기·색·비타민 성분 등과 같은 여러 가지 역할을 한다는 사실은 매우 흥미 있는 일이다. 이상에서 말한 몇 가지 천연색소는 모두 불포화결합이 분자 내에 연결되어 있어, 뒤에 말하는 발색의 원자와 잘 부합된다는 사실을 알 수가 있다.
전자파
빛과 색
색 혹은 빛이라고 하는 것은 라디오나 텔레비전의 전파 또는 X선·감마선 등과 본질적으로 동일한 전자파의 일종이다. 인간의 색각은 넓은 스펙트럼을 갖는 전자기파인 빛의 특정 영역에 대해서만 감지할 수 있다. 이를 가시광선이라고 부른다. 각각의 파장역에 따라 적·황·청이라고 하는 색의 자극으로서 감수되는 것이다.
눈은 망막에 있는 간상 세포와 원추 세포를 통해 색을 느낀다. 눈에는 서로 다른 빛에 더 잘 반응하는 세 종류의 원추 세포가 있다. 이들 원추 세포는 각각 노랑~주황색, 녹색, 파랑의 파장에 가장 잘 반응하며 각각의 원추 세포는 반응 정도에 단백질의 일종인 옵신을 분비하여 시신경을 자극한다. 이것이 색의 특성 중의 하나인 삼원색의 생리학적인 바탕이다.
전자파가 가지는 에너지와 물질
전자파는 파장이 짧아질수록 큰 에너지를 가지고 있다. 우선 비교적 파장이 긴 적외선 영역에서는 그 에너지의 크기가 분자 전체의 운동에너지에 해당하는 것으로부터 분자의 일부인 원자 또는 원자단이 진동하는 에너지에 대응하는 것에 이르기까지 여러 가지가 있다. 따라서 물질에 적외선을 조사하면 분자는 그 운동이 빨라지거나 또는 원자와 원자를 연결하고 있는 결합에 흡수되어 버린다. 또 반대로 OH기가 흡수하는 파장이나 O=C 결합이 흡수하는 파장은 대개 어떤 분자에도 정해져 있으므로, 그 흡수 스펙트럼을 조사하면 분자 속에 어떠한 기가 함유되어 있는가를 알 수가 있다. 다음에 8,000Å 이하의 자외선 영역이 가지는 에너지는 원자핵을 둘러싸는 전자의 에너지상태에 대응하고, 그 전자가 어떤 안정상태에서 여기상태로 옮겨진 때의 에너지차에 해당한다. 그 때문에 이 영역의 전자파를 받으면 전자는 에너지를 흡수하여 여기상태로 된다. 또 반대로 안정상태로 정지될 때는 여분의 에너지를 전자파의 형태로 방출한다. 한편 단파장의 X선이나 알파선 등은 높은 에너지를 가지며, 특히 감마선 등은 원자핵 그 자체를 파괴할 정도의 높은 에너지를 가지고 있다.
유색물질과 무색물질의 차이
전자파가 가지는 에너지는 여러 장소에서 분자에 흡수된다. 이 중에서 가시광선의 부분을 흡수하는 물질은 유색으로 보이게 된다. 그런데 빛의 파장 중 어떤 부분이 흡수되는가는 분자 내의 전자의 상태에 의해 결정된다. 즉 강하게 구속되어 있는 전자를 여기하는 데는 자외선과 같은 파장이 짧은 빛의 에너지가 필요하다. 한편 분자 내에서 전자가 활동하기 쉽게 되어 있는 것은 가시광선 정도의 파장이 갖는 에너지에 의해서도 여기된다. 즉 탄화수소·탄수화물과 같은 유기물질의 대부분은 전자를 구속하는 힘이 강하므로, 전자는 4,000Å 이하인 자외선 영역의 빛에서야 비로소 여기된다. 에너지가 낮은 가시광선은 모두 투과 혹은 반사되어 버린다. 그 때문에 무색으로서 느껴지는 것이 많다. 한편 기타의 착색물질은 그 분자가 가시광선의 빛을 흡수하기 쉬운 전자 상태를 가지고 있다.
변색의 원인

페놀프탈레인 분자
흡수되는 빛의 파장이 전자의 상태로 변한다는 것은 잘 아는 사실이다. 이 원리를 교묘하게 응용한 것이 화학실험을 할 때 사용하는 산·알칼리 지시약이다. 지시약의 색이 변하는 것을 예로 하여, 물체가 착색되어 보이는 원인을 좀더 설명해 보기로 한다. 지시약으로서 사용되는 것에 남미산의 리트머스이끼에서 얻어지는 색소(리트머스액)와 페놀프탈레인 등 여러 가지가 있다. 페놀프탈레인 분자는 (그림-2)에서 보는 바와 같은데, 이것은 무수 프탈산과 페놀로 합성된다. 이것은 원래 그 자체는 무색이지만 약알칼리성으로 되면 선홍색으로 발색한다. 이 때 OH기의 하나는 알칼리와 반응하여 -ONa 등으로 되고, 하나는 =O로 변한다. 또 중앙의 탄소와 산소로 결합되어 있던 카르복시기는 -COONa와 염으로 되어 떨어져 나간다. 알칼리 용액 중에서의 페놀프탈레인 분자의 전자상태 및 산성 또는 중성 용액에서의 전자상태를 비교해 보자. 산성이나 중성인 경우, 3개의 벤젠환은 각기 독립되어 있어서 전자가 회전하는 범위도 벤젠환 내에 국한되어 있다. 한편 알칼리성으로 한 경우에 전자는 중앙의 탄소와 벤젠환의 이중결합을 통해 분자 전체에 펼쳐지게 된다. 즉 전자는 헐겁게 결합된 상태로 된다. 그 때문에 전자는 여기되기 쉽게 되고, 흡수되는 파장이 중성·산성인 경우의 자외선 영역에서 벗어나 5,500Å 전후인 가시광선 부분으로 피크를 이루게 된다. 그 때문에 페놀프탈레인은 적색으로 보이게 되는 것이다.
발색과 원자의 관계
흑연
일반적으로 분자에 길게 연결된 불포화결합이 있으면 전자가 자유로이 활동하는 공간이 커져서 흡수하는 파장이 긴 파장 쪽으로 미끌어져 나오게 된다. (CH=CH)n을 예로 들어 일련의 화합물에서 색이 어떻게 변화하는가를 살펴보기로 하자. n((CH=CH)n에서 n을 말함)이 1∼2인 경우는 무색, 즉 자외부(紫外部)에 그 흡수역이 있는 분자이다. 그러나 n이 3, 4, 5와 같이 그 수가 증가함에 따라 황색 → 오렌지색으로 되고, 7∼11에서는 청색 → 청자색으로 되며, 50 이상에서는 녹흑색으로 변하게 된다. 예로 든 일련의 화합물과 같이 탄소·수소로 된 화합물 중에서 불포화결합이 없는 파라핀이나 석유는 무색이고, 불포화결합만으로 된 흑연은 진흑색인 것도 역시 같은 원리로서 이해할 수 있다.
또 유기물질은 탄소 수소 이외에 산소·질소·황과 같은 원소를 함유하고 있는 것도 있다. 같은 불포화결합이라도 탄소 이외의 원소가 관계하고 있는 경우에는 상태도 각기 다르다. 이와 같이 분자에 존재하는 불포화결합의 유무와 또 그 불포화결합의 종류에 따라서 분자는 색을 달리하게 된다. 이와 같이 발색에 관계하는 결합을 '발색단(chromophore)'이라고 하며, 제각기 특별한 명칭이 붙어져 있다. 이 밖에 -NR2, -NHR, -NH2, -OH, -OCH3 등의 원자단이 발색단과 결합되어 있으면 색이 잘 나타나게 되므로, 이러한 원자단을 '조색단'이라고 한다.
빛과 색
색
물체의 색은 모양과 더불어 사람이 바깥 세상의 사물을 알아보는데 중요한 역할을 한다. 우리는 어떻게 색을 느낄 수 있을까? 물체가 고유의 색을 가진 것처럼 보이는 이유는 무엇일까? 물체에 빛이 비추어지는 상황에 따라 색이 달라져 보이는 것이나 빛이 없으면 색도 없어지는 것으로 보아 색은 빛과 밀접한 관계가 있음을 알 수 있다.
그림은 빨강, 노랑, 파랑의 색의 삼원색과 이들을 조합하여 만들어 낼 수 있는 색이다. 이 삼원색을 기본색이라 하고 이들이 1:1 조합되어 만든 색을 이차색, 이차색이 1:1로 조합된 색을 삼차색이라 한다.

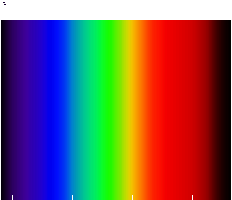
빛의 분해
빛을 아래 그림처럼 프리즘에 비추거나 비온 뒤 무지개를 보면 빨주노초파남보의 7색으로 나누어 지는 것으로 보아 백색의 태양빛이나 불빛이 실은 그 속에 많은 색의 요소를 가지고 있음을 알 수 있을 것이다. 파동으로서의 빛이 파장이나 진동수에 따라 물질에서 빛의 속도가 다르기 때문에 프리즘이나 물방울에 의해 빛은 파장별로 분해가 되고 이로부터 파장이 바로 색을 결정한다고 할 수 있다. 물질의 굴절률이 파장(진동수)에 의존하는 것을 분산이라 한다.
분산을 이용한 프리즘으로도 빛의 파장을 측정할 수 있지만 빛의 회절을 이용한 회절격자로 파장을 더 정밀하게 측정할 수 있다. 회절각과 회절격자 틈 간격으로 파장을 표현할 수 있어 유리의 분산특성을 알아야 하는 프리즘의 경우보다 더 직관적이고 정확하다.
유리를 삼삭기둥 형태로 만들어 빛를 비추면 파장에 따라 꺽어지는 각도가 달라 그림처럼 무지개 색이 보인다. 이 프리즘은 유리의 빛의 분산 특성을 이용한 것이다.
회절격자는 무수히 많은 슬릿이 같은 간격으로 평행하게 배열되어 있어 파장에 따라 특정한 몇 방향으로 빛을 꺽어주게 된다.
가시광선
우리 눈은 빛의 파장에 따라 색을 다르게 인식하지만 파장이 일정한 범위를 벗어나게 되면 빛을 감지하지 못한다. 대체로 파장이 400nm~700nm 범위가 빛을 특정한 색으로 느낄 수 있어 이를 가시광선이라 한다. 좁은 의미로서의 빛은 우리가 인지할 수 있는 가시광선을 말하고, 넓은 의미에서는 파장에 관계없이 전자기파 전체를 말한다.
가시광선의 파장범위는 대체로 태양에서 나오는 흑체복사의 주요한 파장의 범위와 일치한다. 이는 태양이 지구의 생명체의 원천이 되었다는 사실과 밀접하게 관련되어 있다.
태양의 스펙트럼으로 400nm~700nm범위의 빛을 강하게 방출한다. 그리고 약하지만 700nm 이상의 적외선, 400nm 이상의 자외선도 방출하나 우리 눈은 이를 느낄 수 없다.
색의 인식
우리 눈의 망막에는 추상체, 간상체라는 두 종류의 시세포가 있는데 한낮의 밝은 상황에서는 추상체가 자극되어 색을 느낄 수 있지만 밤이나 어두운 조명에서는 추상체보다 더 감도가 뛰어나지만 색에 대한 식별력이 없는 간상체가 작용하여 흑백사진과 같은 영상을 느끼게 된다. 추상체 내에는 특정한 파장에 민감하게 반응하는 세 종류의 세포가 있어 각 세포에 걸리는 자극의 정도에 따라 색을 다르게 느끼게 되는 것이다. 아래 그림은 이 세 종류의 세포가 감응하는 파장의 범위와 감도를 나타내고 있다. R로 표현한 세포는 가시광선 전체에 걸쳐서 넓게 빛을 받아들이지만 대체로 붉은 빛에 속하는 580nm 주변을 더욱 강하게 받아 들인다. 한편 G는 노랑과 녹색을, B는 청색을 느낀다. R, G, B의 세 세포에 걸리는 자극의 강도가 달라지면 색을 다르게 느끼고, 실제의 스펙트럼이 다르다 하여도 세 자극의 자극이 같다면 같은 색으로 느낀다.
우리 눈의 망막에 있는 추상체의 R, G, B 세 세포가 인지하는 파장별 자극의 정도를 나타낸 그래프로서 이 세 자극 값에 따라 색을 다르게 느낀다.
CIE 색도와 색의 표현
색의 명명
사람이 어렸을 때 색을 느끼고 식별하게 된 이후 나이가 들어감에 따라 색에 대한 분별력이 커진다. 보통 따로 떨어진 별개의 색의 경우 수십 종을, 색에 대한 감각이 아주 뛰어난 화가도 1000종 정도를 별개의 색으로 알아본다. 그러나 두 색을 나란히 놓고 비교시켰을 때 양쪽이 같은 색인가 다른 색인가를 식별하는 능력은 아주 뛰어나서 750만 색을 분별할 수 있다. 50여종이라면 그 색이 대표하는 물체의 이름이나 복합어로서 나름대로 색의 이름을 붙일 수 있지만 750만 색의 정도라면 명명이 불가능 해진다. 이에 따라 색채를 수치로 명명할 수 있는 표색의 여러 방법이 고안되었다.
사람은 눈의 세 개의 세포에 주어지는 자극의 값으로 색을 인지하므로 이 자극의 값을 색을 표현하는 기본 수치로 삼을 수 있을 것이다. 즉 임의의 색은 삼차원상의 한 점으로 나타낼 수 있게 된다. (실제로 파장별 스펙트럼 분포는 임의의 함수형태이므로 무한 차원이라 할 수 있어 프리즘이나 회절격자에 비하여 우리의 색 인식능력은 훨씬 미약하다고 할 수 있다.)
색의 측정
분해하려는 빛을 흰 종이에 비추고, 다음 그래프로 표시한 스펙트럼의 분포를 가지고 있는 세 개의 전등을 합성하여 옆에 비추어 서로 비교한다. 이때 세 전등은 밝기를 조절할 수 있어 미지의 빛과 같은 색으로 느끼도록 각각을 조절한다. 이때 세 전등에 걸리는 전류나 거리로부터 밝기를 산출하여 이 세 값으로 미지 빛의 색의 값으로 삼는다. 여기서 r1의 경우 - 값으로 표현한 것은 밝기가 음의 값일 수 없으므로 미지의 빛에 음으로 표현한 양만큼 추가로 비추어 주고, r1의 경우 음의 밝기를 0으로 삼아주는 것을 말한다.
CIE 색도
위에서 설명한 실험의 절차로 빛의 색도를 알아내는 것은 매우 번거로우므로 우선 색을 알고 싶은 미지의 빛의 스펙트럼 - 파장별 밝기 를 분광장비를 이용하여 측정한다. 그리고 이 함수를 오른쪽의 그래프로 표현한 모함수와 곱하여 적분량을 구하여 이를 각각 X, Y, Z라 하자.
(왼편 식처럼 빛의 색을 X, Y, Z로 표현하면 P1, P2의 두 빛이 합성되었을 때 X, Y, Z값은 벡터처럼 합성된다.)
즉 세 그래프는 색의 세 좌표값을 값을 구하기 위한 모함수가 된다. 한편 색은 상대적인 값에 의존하므로 X, Y, Z의 세 값을 다음과 같이 X+Y+Z로 규격화하여 각각을 x, y, z라 하고 이를 색을 표현하는 좌표 값으로 삼을 수 있을 것이다. 여기서 x+y+z는 규격화에 의해 1로 유지되므로 한 색상은 x, y, z 중 두 값으로 표현된다.
(빛의 색을 x, y, z로 표현하면 빛의 절대적인 밝기 정보는 없어진다. 한편 P1, P2의 두 빛이 합성되었을 때 x, y, z값은 각 성분의 평균값으로 된다.)
한편 Y값은 빛의 밝기(명도)를 적절히 나타내고 있으므로 x, y와 Y로 색을 명명하여 이를 CIE 색도라 한다. (CIE : 국제조명위원회, Commission International de l’Eclairage)
xyY의 이 CIE 색도는 뒤에 설명할 다른 색도법에 비하여 색의 심리물리학에 입각한 과학적인 방법으로서 영상표시, 인쇄 등에 응용되고 있다.
오른편 그림은 CIE 색도계 값의 xyY의 (x, y)를 이차원 평면 위에 나타내었다. 그림에 나타난 말굽형의 부분은 모든 조합가능한 스펙트럼의 분포에 대응된 것이다. 가장자리의 푸른색으로 표현한 부분은 단색광에 대응되고, 태양의 스펙트럼 분포는 중앙부분의 흰색의 영역이 된다. 오른편 꼭지점은 약 700nm의 단색광이고 파장이 짧아짐에 따라 윗 방향으로의 가장자리 곡선을 따라가서 400nm의 단색광이 되면 x축과 붙어 있는 꼭지점에 이른다. 한편 이러한 단색광이 합성된 복합광은 두 지점을 가중평균한 지점이 되어 두 지점을 이어준 선 상에 놓이게 된다.
그림에서 말발굽 아래부분의 직선부분은 700nm의 붉은 빛과 400nm의 보라색이 섞여서 만들게 되는 자주색의 영역으로서 이는 단색광에 대응되는 파장이 존재하지 않는 특이한 색이다.
색의 혼합과 보색
적색광과 녹색광을 흰 종이에 비추면 각각에 비하여 더 밝은 노란색이 된다. 이처럼 빛을 더해서 혼합하는 것을 가산혼합이라 한다. 이 가산혼합의 원리는 위에서 설명한 CIE 색도로 쉽게 이해할 수 있다. 즉 빛의 색은 (X, Y, Z) 삼차원의 벡터로 표현할 수 있어 벡터의 합성과 같이 빛의 혼합을 다룰 수 있다(Grassman의 색채법칙).
A와 B의 두 빛을 혼합하면 이들 밝기의 비로 가중평균한 지점의 색이 된다. (Grassman의 색채 제2법칙)
세 색을 조합하여 만들어 낼 수 있는 색의 영역은 세 색이 만드는 삼각형 내부이다. 위 그림은 세 개의 색으로 가장 넓은 색도를 만들어 낼 수 있는 경우를 보여준다. 이 세 색을 삼원색이라 한다.
서로 섞었을 때 색이 사라지는, 즉 백색이 되는 색을 서로 보색이라 한다.
색대역(color gamut)
칼라모니터는 빨강, 녹색, 파랑 세 개의 색의 형광물질이 발려져 있어 가속된 전자가 이곳을 때려주면 각각의 색이 빛난다. 이 경우 칼라모니터가 만들 수 있는 색의 영역은 세 색을 정점으로하는 삼각형 내부의 색으로서 이를 칼라모니터의 색대역이라 한다. 이 색대역은 색을 표현하는 표시장치에 따라 영역이 크게 달라진다. 유한한 색을 조합하여 만들 수 있는 색은 CIE 색도에서 유한한 색을 정점으로 한 다각형 내부일 것이다. 자연의 모든 색, 즉 CIE 색도의 말굽형 전체의 색을 그런대로 잘 만들어내기 위해서는 되도록 가장자리에 속하는 색을 기본요소로 하는 색소를 세 개 이상으로, 되도록이면 많이 도입되어야 할 것이다.
칼라모니터의 색대역으로 R, G, B 세 색소가 만드는 빛의 밝기에 따라 삼각형 내부의 모든 색을 만들 수 있지만 바깥의 색은 근본적으로 만들 수 없다. 따라서 이 교재의 화면을 모니터로 보는 경우에는 바깥의 영역은 색은 제대로 표현되지 않을 것이다.
다른 색모형(color model)들
RGB 색모형
RGB 색모형은 빛의 삼원색인 빨강, 녹색, 파랑의 세 색의 합성성분으로 임의의 색을 표현한다. 이 모형은 칼라모니터의 색 대역과 일치하므로 텔레비젼, 컴퓨터 모니터등의 표현장비에 적용하기 적합하다.
RGB 색모형에서 기본색 세 개로서 이를 빛의 삼원색이라고도 한다. 이는 거의 칼라모니터의 색소와 일치한다. 임의의 색은 0~1사이의 R, G, B값으로 표현되되 색대역인 삼각형내부의 색만을 표현할 수 있다.
RGB 값에 따라 정육면체 내부의 임의의 색을 표현한다. R, G, B값이 모두 0이면 검은색(Black)이 되고, 모두 1의 값이면 흰색(White)가 된다.
왼편 그림에서 R, G, B 세 색상을 조절하는 슬라이드바를 움직여 보자. 세가지 색상의 조명등의 밝기를 조절했을 때 여러 다른 색을 만들 수 있다. 여기서 최대값은 255로서 세 색이 최대값이 되면 모두가 합쳐진 부분은 흰색이 된다.
아래 프로그램은 그림에 R, G, B 세 색상의 빛으로 조명하여 일부분을 볼 수 있는 상황이다. 처음에 나타나는 화면의 가운데 부분은 R, G, B 세 색을 동일하게 비추어서 원래의 색상 그대로 알아볼 수 있다. "시작" 버튼을 누르면 세 색의 조명이 이리저리 움직여서 그림의 다른 부분을 비추게 된다. 한편 "전체보기" 버튼을 누르면 그림의 전모를 파악할 수 있다. 브라우저의 "새로고침(reload)"를 실행하면 다른 준비된 그림이 나타날 것이다.
CMY 색모형
CMY 색모형은 청록(시안:Cyan), 마젠타(Magenta), 노랑(Yellow)의 세 색을 기본색으로 색을 이 세 색의 조합으로 표현한다. 이 경우에는 색을 합성할수록 어두워지는 감산혼합의 원리를 적용하여 C, M, Y의 세 값이 0이면 흰색이 된다. 이 모형은 페인팅, 인쇄, 칼라프린터 등에 적용하기 좋다.
Cyan, Mggenta, Yellow 세 색을 삼원색으로 하여 임의의 색은 0~1사이의 C, M, Y 값으로 표현한다. (이 세 색을 색의 삼원색이라 한다. 빨강, 노랑, 파랑을 색의 삼원색으로 잘 못 알고 있는 경우가 많은데 이는 틀린 표현이다.)
CMY 값에 따라 정육면체 내부의 임의의 색을 표현한다. C, M, Y값이 모두 0이면 흰색(White)이 되고, 모두 1의 값이면 검은색(Black)이 된다.
HSV 색모형
HSV의 색의 표현은 우리의 색에 대한 감각과 비교적 일치하는 모형이다. RYGCBM의 여섯 색상을 기본으로 하여 이들을 원주상에 60도 간격으로 배치한다. 이들을 등간격으로 분할한 색을 인접 기본색의 합성으로 만들어 내어 전체의 원주를 완성한다. 이를 색상환이라 한다. 이 색상환에서의 위치는 색상(Hue)의 H값으로 한다. 한편 채도(Saturation)의 S값은 CIE 색도에서 가장자리로 갈수록 큰 값을 가지고, 이 값이 0인 경우는 중심의 흰색이 된다. 또한 명도(value)는 색의 밝기를 나타낸다. 예를 들어 순수한 빨강색은 H값이 0(도), S값이 1, V값이 1이고, 녹색은 H값이 120(도), S=1, V=1이다.
여섯의 색을 색상환의 원주상에 배치하여 색상을 나타낸다.
HSV 값에 따라 임의의 색을 나타낸다. 여기서 H는 색상의 값, S는 채도, V는 명도를 나타낸다. 색상 H는 우리가 색을 명명하는 "빨강, 주홍, 주황, 노랑, ... " 등의 순서에 따라 값이 커져 우리의 색감각과 비교적 일치하는 모형이다.