몰(mole)
① 몰 : 원자나 분자의 수를 헤아리는 단위
② 아보가드로수(NA, Avogadro number) : 1몰에 포함된 원자의 수. 즉 12C 12.00 g에 포함된 원자의 수
NA = 6.02 × 1023개
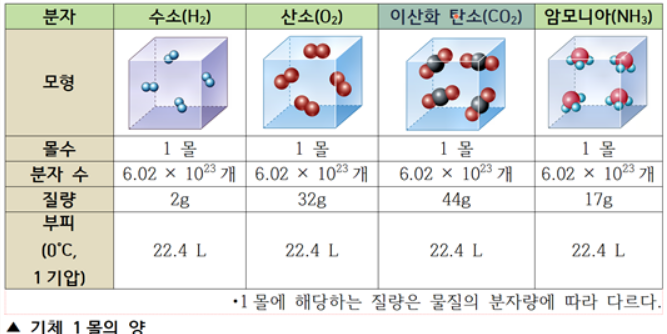
③ 기체 1몰의 부피는 기체의 종류에 관계없이 일정, STP(0 ℃, 1 기압)에서 기체 1몰의 부피는 22.4 L
○ 이상기체 상태방정식으로부터 유도
④ 사람은 약 10,000 몰로 구성돼 있음
몰(mole, 기호: mol)은 물질량을 나타내는 국제단위계의 기본 단위이며, 화학에서 많이 쓰이는 단위이다.
통상적으로 '입자'란 분자로 이루어진 물질의 경우 분자, 혹은 결정 따위의 경우 실험식의 단위 따위를 일컬으며 때로는 원자, 전자, 광자 등의 수를 나타낸다. 거시적 계의 입자수는 직접적으로 측정하기 어렵고, 또 측정하더라도 너무 크기 때문에 편의상 물질량이라는 새로운 측정량을 도입하였다.
2019년 SI 기본단위 재정의 전에는 1몰은 탄소-12 12 g의 원자의 물질량으로 정의되었다. 하지만 2019년에 아보가드로 상수가 NA = 6.022 140 76×1023 mol−1가 되도록 하는 단위로 재정의됐다. 1몰에 해당하는 입자의 수인 6.022 140 76×1023은 아보가드로 수라고 부른다.
용액의 농도를 물질량을 이용하여 표시할 수 있는데, 몰랄 농도는 단위 질량의 용매 속에 들어 있는 용질의 물질량이며, 몰 농도는 단위 부피의 용액 속에 들어 있는 용질의 물질량이다.
아보가드로 수와 몰
(Avogadro's Number and the Mole)
몰(mol)은 물질의 입자 수, 질량, 부피 등과 같은 물질의 양을 나타내는 매우 작은 입자의 묶음 단위이다. 가장 기본적으로 원자, 분자, 이온 등과 같은 입자의 수 약 6.022×10^23개를 1몰(mol)로 정한 묶음 단위이다. 이들 입자들은 실제 크기, 질량 등이 매우 작으므로 입자 한 개 한 개 등 낱개의 양으로 다루기엔 매우 불편하다. 그러므로 이 작은 입자들의 양을 다룰 때는 묶음 단위를 사용하는 것이 편리하다. 이와 같이 크기나 양이 매우 작아 실제 사용하기에 불편한 경우 그 물질량을 이해하는데 좀더 편리하도록 묶음 단위를 만들어 쓰는 것이다. 방법은 원자량의 기준에 따라 질량수가 12인 탄소(12C)의 질량 12g 중에 포함되어있는 원자의 수를 1몰(mol)로 정했다. 즉, 탄소 (12C)의 질량 12g 속에는 탄소 원자가 약 6.02×10^23개 들어있는데, 이를 1몰이라 한다. 그뿐 아니라 입자의 종류에 관계없이 6.02×10^23개를 1몰이라고 이 1몰의 수를 아보가드로 수(NA: Avogadro's number)라고 부른다. 물 분자를 예를들면 물 1몰의 질량은 18g 이므로 6.02×10^24개 이다.
원자량은 원자의 상대적인 질량으로서 C(12), H(1), O(16), N(14) 이며 C 1개 질량 = H12개 질량과 같다. 분자량도 분자의 상대적인 질량으로 H2O(18), CH3(16) 과 같이 원자량의 합이다. 몰은 입자수를 나타내는 단위로서 1몰은 6.02×10^23 개로 이것이 모이면 그때의 부피는 22.4L가 된다. 만약 어떤 원자 1몰이 모였을 때 질량은 원자량에 g을 붙인 값이 되고, 분자 1몰이 모였을 때 질량은 분자량에 g을 붙인 값이 된다.
예) CO2 22g은? (CO2 = 44g이 1몰)
따라서 1/2몰이며 부피는 1/2 X 22.4L, 분자수는 1/2 X 6.02×10^23개 이다.
1) 몰이란
- 갯수 단위
- 분자를 뜻하는 Molecule에서 따온 것
- 원자, 분자 및 이온과 같이 작은 입자의 갯수를 세기 위한 묶음 단위
- 기호로 mol이라고 표시하여 사용
- 1몰은 입자 6.02 x 10²³개의 집단을 말하며, 이 수를 ‘아보가드로수 Avogadro constant, NA’ 라고 함
- 1몰: 질량수가 12인 탄소 원자(12C)12g속에 들어있는 입자 수를 1몰로 정의 - 그 속에 포함된 탄소 입자의 개수는 정확히 6.02 x 10²³개
1M(mol/L) 포도당 수용액 1L를 만들려고 할 때 포도당 1mol을 만들어야 하는데
포도당 1mol=6.02 X 10^23개인데 갯수를 셀수는 없고 포도당 1mol만큼의 질량을 알고 있으면 된다. 포도당의 분자량은 180이다. 따라서 1mol 포도당은 180g이다. 다음 예제로 산소기체 1mol을 구할 때 산소 분자량은 32g 이다. 그렇다면 32g만큼 구하면 되지만 기체 질량 측정이 어려운 관계로 여기서는 부피로 나타내면 된다. 0도씨 1기압일 경우 기체 종류에 상관없이 22.4L이다. 따라서 몰수를 구할 때는 제시값을 기준값으로 나눠주면 된다.
제시값/기준값 = 질량/화학식량(원자량 또는 분자량) = 부피/22.4L =몰수
H2O 분자 1몰에는 6.02 x 10^23개가 있고 원자는 총3개가 있으니 3몰이 된다. 즉 3 X 6.02 x 10^23개 이다.
2) 1몰 갯 수
연필 1다스 = 12개
1몰 = 6.02 x 10²³개
산소원자 1몰의 갯수는? 6.02 x 10²³개
물분자 1몰의 갯수는? 6.02 x 10²³개
수소 이온 1몰의 갯수는? 6.02 x 10²³개
몰수 X 아보가드로수 =입자수
예) 물분자 3,01X 10²³개 있다. 물분자 몰수는?
몰수 = 입자수/아보가드로수
0.5몰
3) 1몰 질량 (다르다)
몰수 X 화학식량 = 전체질량
탄소원자 1몰: 탄소원자량은 12이므로 질량은 12g
산소원자 1몰: 산소원자량은 16이므로 질량은 16g
수소원자 1몰: 수소원자량은 1이므로 질량은 1g
수소분자 1몰: 수소분자량은 2이므로 질량은 2g
물분자 1몰: 물분질량은 18이므로 18g
물분자 3몰 질량은 18 X 3 = 54g
4) 1몰 부피 (같다)
기체의 종류에 관계없이 모든 기체는 압력과 온도가 같은 때 같은 부피 속에 들어 있는 기체의 분자 수는 같다.
1몰의 부피는 22.4L
몰수 X 22.4L = 기체의 부피
예) 0도 1기압에서의 암모니아 11.2 L에 들어있는 몰 수? 질량은?
몰수: 11.2L/22.4L = 0.5몰
질량: NH3 = 14 + 3X1 =17 (1몰일 경우, 여기서는 0.5몰이므로)
0.5몰 X 17 = 8.5g
- 원자량, 분자량 = 화학식량
H: 1 H₂: 2
O: 16 O₂: 32
C: 12 CO: 28
N:14
Na:23
Cl :35.5
Ca:40
1몰 질량은 다르다.
1몰 부피는 같다.
- 예 1) H₂가 12X 10²³개이다 몰수는? 12X 10²³/ 6X 10²³= 2몰
- 예 2) H₂(g) 기체 부피가 44.8L는 몇 몰인가? 44.8L / 22.4L = 2몰
- 예 3) H₂가 4g 있다. 몇 몰인가? 4g/ 2g = 2몰
5) 밀도와 몰
- 퍼센트 농도: 용질(g) / 용액(용매+용질)(g) X 100
- 몰농도(M): 용질 mol /용액 L
예) NaOH 10g을 증류수에 용해시켜 500 mL 용액을 만들었다. 이 용액의 몰농도를 계산하라.
용질의 mol수 = (10 g) / (40 g/mol) = 0.25 mol
용액의 L수 = 500 mL = 0.5 L
따라서 몰농도= 0.25 mol / 0.5 L = 0.5 mol
<Summing-up>
1. Converting from mass (grams) to moles: Divide your initial mass by the molar mass of the compound as determined by the periodic table.
Example: Convert 25.0 grams of KMnO4 (Potassium permanganate) to moles.
Solution:
- Step One:
The problem will tell you how many grams are present. Look for the unit of grams. The number immediately preceeding it will be how many grams. Common abbreviations for grams include g (just the letter) and gm.
I suppose that a problem can be worded in such a way that the number of grams comes after the unit, but that type of trickery isn't very common in high school.
The problem gives us 25.0 grams.
- Step Two:
You need to know the molar mass of the substance. Please refer to the lessons about calculating the molecular weight and molar mass of a substance if you are not sure how to calculate a molar mass.
The molar mass of KMnO4 is 158.034grams/mole. Please take a moment and calculate the molar mass of KMnO4, just to be sure.
- Step Three:
Divide the grams given in the problem by the substance's molar mass:
25.0g / ( 158.034 g/mol ) = 0.158 mol
The answer of 0.158 mole has been rounded to three significant figures because the 25.0 value had the least number of significant figures in the problem.
2. Converting from moles to mass (grams): Multiply your initial mole value by the molar mass of the compound as determined by the periodic table.
One of the most common chemistry calculations is converting moles of a substance into grams. When you balance equations, you'll use the mole ratio between reactants and reagents. To do this conversion, all you need is a periodic table or another list of atomic masses.
Example: How many grams of carbon dioxide is 0.2 moles of CO2?
Look up the atomic masses of carbon and oxygen. This is the number of grams per one mole of atoms.
Carbon (C) has 12.01 grams per mole.
Oxygen (O) has 16.00 grams per mole.
One molecule of carbon dioxide contains 1 carbon atom and 2 oxygen atoms, so:
number of grams per mole CO2 = 12.01 + [2 x 16.00]
number of grams per mole CO2 = 12.01 + 32.00
number of grams per mole CO2 = 44.01gram/mole
Simply multiply this number of grams per mole times the number of moles you have in order to get the final answer:
grams in 0.2 moles of CO2 = 0.2 moles x 44.01 grams/mole
grams in 0.2 moles of CO2 = 8.80 grams
3. Converting from volume (liters) to moles: Divide your initial volume by the molar volume constant, 22.4 L.
How many moles of helium at STP will fit into a 39.6L container?
Set up equation
39.6L He / 22,4L He = 1.77 mol He
4. Converting from moles to volume (liters): Multiply your mole value by the molar volume constant, 22.4L.
Determine the volume, in liters, of 0.60 mol SO2 gas at STP.
Set up equation
Volume = 0.60 mol SO2 X (22.4L/1 mol) =13L SO2
5. Converting from particles (atoms, molecules, or formula units) to moles: Divide your particle value by Avogadro’s number, 6.02×10^23. Remember to use parentheses on your calculator!
If you had a bottle that contained 5.69x10^24 molecules of water, how many moles of water does the bottle hold?
5.69x10^24 mc H2O / 6.02×10^23 = 9.45 moles H2O
6. Converting from moles to particles (atoms, molecules, or formula units): Multiply your mole value by Avogadro’s number, 6.02×1023.
How many atoms can be found in 3.91 moles of xenon?
3.91 moles Xe X (6.02×10^23/ 1 mole Xe) = 2.35 X 10^24 atoms Xe