원자구조 : 원자 = 원자핵 + 전자 , 원자핵 = 양성자 + 중성자
크기비교 :
원자의 크기 : 약 10-10m = 0.1nm=1Å
원자핵 의 크기 : 약 10-14 ~ 10-15m, ex) 야구장(원자) 안에 10원짜리 동전(원자핵)
무게비율 :
양성자 : 중성자 : 전자 = 1 : 1 : 1/1840, 전자의 무게는 무시 가능할 정도로 작다.
전자 (電子, electron) 는 음(-)의 전하를 띠고 있는 기본 입자이다.
원자 내부에서 양성자(陽性子, Proton)와 중성자(中性子, Neutron)로 구성된 원자핵의 주위에 분포한다.
양성자(陽性子, Proton)는 중성자와함께 원자핵을 구성하며 양(+)의
전하를 가지고 있으며 질량은 전자의 1836배 정도이다.
중성자(中性子, Neutron)는 원자핵을 구성하는 무 하전(無荷電) 입자이다.
전자의 역사는 톰슨(J. J. Thomson, 1856-1940 영국 맨체스터 출생, 노벨 물리학상_1906년 ) 의 음극선 실험에서 0.1Pa의 낮은 기압에서의 진공방전에서 엷은 연두색의 형광 빛이 생기는 것을 보았다. 또한 그 빛은 음극에서 나와 양극으로 흘러갔다.
화학에서는 주로 원자가 전자에 대해 주목하는데, 그 이유는 전자가 원자의 성질을 결정하는 데 중요하기 때문이다. 원자가 전자가 1개이면 알칼리 금속으로 양이온이 되며 특히 할로젠 원소와 격렬히 반응한다.
원자의 최외곽 전자가 8개이면 일원자분자 형태로 존재하고 비활성 기체로서 반응을 거의 안 하는데 그 이유는 옥텟 법칙(Octet rule) 에 따라 최외각 전자가 8개일 때 원자가 가장 안정하기 때문이다.
원자량(原子量, Atomic Weight)의 정의 : 질량수 12인 탄소 원자를 12.00으로 정하여 나타낸 상대적인 질량비를 말한다.
평균 원자량은 자연계에 존재하는 동위 원소 간의 질량수를 평균한 값을 의미한다.
분자량(分子量,Molecular Weight)과 화학식량(化学式量,Chemical Formula Weight)는 구성 원소의 원자량을 모두 더한 값을 의미한다.
ex) 물과 에탄올의 분자량 및 화학식량은 ?
H2O = 1x2 + 16 = 18
C2H5OH = 12x2 + 1x5 + 16x1 + 1x1 = 46
세상을 이루는 최소단위 입자
1리터의 물이 있다고 상상해봅시다.지금부터 이 물을 더 이상 쪼개어지지 않을 때까지 반씩 나눠보도록 하겠습니다.
1리터의 물을 반으로 나누고. 그 반을 또 반으로 나누고. 그 반을 또 반으로 나누고. 이 나누는 과정을 14번 정도 반복하고 나면 1리터의 물에서 한 방울 정도 크기의 물로 줄어들게 됩니다.
지금도 충분히 작은 크기이지만 이 물방울을 계속해서 더 나눠본다고 상상해봅시다.
반으로 나누고 그 반을 또 반으로 나누고... 지금까지만 보면 이 물을 나누는 작업은 끝이 없는 무의미한 행동 같아 보입니다. 하지만 1리터의 물을 85번 나누고 나면 우리는 물의 성질을 갖는 최소단위의 입자인 물 분자를 만나볼 수 있게 됩니다. 그럼 이 분자가 과학에서 말하는 세상을 이루는 가장 최소단위 입자 일까요?
아니죠. 우린 기본적으로 원자도 알고 있습니다.
1774년 근대 화학의 창시자라 불리는 프랑스의 화학자 라부아지에는 여러 실험적 결과들을 토대로 과학의 가장 기본법칙 중 하나인 질량보존의 법칙을 발표하게 됩니다.
질량보존의 법칙이란, 물질을 구성하는 성분들은 결코 무로 사라지지도 무에서 새로 생성되지도 않으며, 그 질량은 새로이 화합된 물질의 일부로 남는다는 것이죠.
그리고 1799년 프랑스의 화학자 푸루스트가 역시 실험적 결과들을 토대로 일정성분비의 법칙을 발표하게 됩니다.
일정성분비의 법칙이란, 화학반응에 의해 생성되는 모든 물질의 성분들은 항상 정수배의 일정한 질량비를 갖는다는 것입니다. 간단한 예로 물의 경우 화학반응을 통하여 분해하면 물 전체 질량에서 1.5대 7.5도, 0.5대 8.5도 아닌 정확히 1대 8의 비율로 수소와 산소로 분해되고, 다시 물을 생성하려해도 정확히 수소 1과 산소 8의 비율이 필요하다는 것이죠.
그리고 다른 원소들도 각각의 특정 성분비를 지니고 있으며, 이것은 우주 어느 곳에서건 같은 비율로 적용된다는 것입니다.
그로부터 9년이 지난 1808년, 영국의 화학자 존 돌턴이 이 두 법칙의 작용 이유를 명쾌한 방법으로 설명하게 됩니다.
모든 물질은 특정 단위 질량을 지닌 더 이상 쪼개어질 수 없는 입자들로 이루어졌기 때문이라고 말입니다.
이것을 돌턴의 원자설이라 하며, 인류 역사상 과학적 실험을 근거로 둔 첫 원자론이 됩니다.
그리고 이 돌턴의 원자설은 이후 여러 화학실험과 물리실험의 결과들을 설명 가능케 하면서 차츰 정설로 받아들였죠.
그러나 돌턴의 원자가 물질을 구성하는 최소단위 입자라는 과학계의 입장은 1897년 J.J.톰슨에 의해 깨지게 됩니다.
1897. J.J.톰슨의 전자의 발견

우리가 가스레인지에서 쉽게 볼 수 있는 전기 스파크. 이것을 공기를 뺀 진공상태의 유리관으로 옮겨보면 더 긴 길이의 전기 흐름을 관측할 수 있게 됩니다. 이것을 음극선이라 하죠.
음극에서 나와 양극으로 흘러 들어가는 빛이라는 뜻입니다.
당시 과학자들은 음극선을 빛과 같은 전자기파의 일종이라 생각했습니다. 하지만 톰슨은 음극선의 이동 속도가 전자기파의 이동 속도보다 느리고 바람개비를 돌릴 만큼 질량을 지니고 있으며, 자기장이나 전기장에 의해 휘어지는 것을 발견하곤 그 흐름을 음극 쪽의 원자에서 떨어져 나온 마이너스 전하를 띤 어떠한 입자들의 흐름 일 것이라 생각하게 됩니다.
그리고 톰슨은 자기장의 세기에 따라 음극선이 휘어지는 정도를 측정하여 음극선의 전하와 질량의 비를 계산해내게 되죠.
전기적 성질이 마이너스이며 질량을 지닌 입자. 전자를 처음 발견한 것입니다. 하지만 이것은 말 그대로 전하 대 질량의 비율입니다. 톰슨은 음극선이 질량을 지닌 입자의 흐름이라는 것은 알았지만 입자의 크기가 너무 작아 입자 한 개가 갖는 전하량과 질량을 구해내지는 못했던 것이죠.
이것을 1909년 미국 물리학자 밀리컨이 기름방울 실험을 통해서 계산해내게 됩니다.
1909. 미국 물리학자 밀리컨의 기름방울 실험
원통형 안에 위 아래로 전압을 걸어준 극판을 놓고 위쪽 극판 구멍에 분무기 노즐과의 마찰로 인해 마이너스 전하를 띠게 된 아주 미세한 기름방울을 분무한다고 가정하여 봅시다.
이때 위쪽 플러스 극판에서 띤 기름방울을 끌어당기는 전기력과 기름방울을 아래로 끌어당기는 중력의 크기가 서로 같다면 기름방울은 두 판 사이에 정지해 있을 것입니다.
여기서 기름방울의 무게와 두 극판 사이의 거리, 그리고 두 극판에 걸어준 전압의 크기 등을 안다면 우리는 기름방울의 전하량을 알 수 있게 되죠.
이 실험에서 밀리컨은 기름방울들의 전하량이 항상 특정 숫자의 정수배만큼 만을 갖는다는 것을 발견해내게 됩니다.
이것은 그 특정 숫자가 전하를 지닌 입자가 가질 수 있는 최소단위의 전하량이라는 것을 뜻하는 것이었죠.
그리고 그것은 톰슨이 예측한 전자 1개의 전하량이 될 것입니다.

이 전하량을 앞서 톰슨이 구한 전하와 질량의 비에 대입해보면 전자 1개의 질량을 알 수 있게 됩니다.
이와 별도로 전자의 존재를 발견하였던 톰슨이 1904년 돌턴의 원자모형에서 변형된 새로운 원자모형을 제시하게 됩니다. 플러스 전하의 물렁물렁한 푸딩과 같은 원자에 마이너스 전하를 지닌 전자가 알알이 박혀있는 모양 말입니다.
그로부터 7년 후인 1911년. 톰슨의 제자인 어니스트 러더퍼드가 얇은 금박에 무거운 알파입자를 발사시키는 실험을 진행합니다.
만약 톰슨의 원자모형이 맞다면 모든 알파입자는 가벼운 전자에 방해를 받지 않고 물렁한 푸딩 형태의 원자를 통과하여 금박 뒤 벽면에 흔적을 남기게 될 것이었죠. 하지만 실험결과는 금박을 향해 발사된 알파입자 중 튕겨 나오는 입자가 있다는 것을 발견하게 됩니다.
러더퍼드는 이 실험결과를 통하여 원자의 대부분이 빈 공간이며, 중앙엔 원자 질량 대부분을 지닌 자 그마한 원자핵이 존재함을 밝혀냅니다.
그리곤 톰슨의 원자모형에서 발전시킨 전자가 원자핵 주변을 돌고 있는 행성 모양의 원자모형을 제시하게 되죠.
그리고 이 이론을 받아들인 톰슨의 또 다른 제자인 닐스 보어가 1913년, 수소 원자의 스펙트럼 실험 결과를 토대로
원자핵 주변의 전자는 특정 레벨의 궤도 안에서만 돈다는 전자를 양자화시키는 이론을 발표하게 됩니다.
그다음은 하이젠베르크의 불확정성원리 등 양자역학의 시대가 시작된 것이죠.
이와 별도로 금박에 알파입자를 충돌시켜 원자핵을 발견했던 러더퍼드는 이 실험을 다른 원자들에 대해서도 계속 진행하였습니다. 그런데 그 과정 중 특이한 점 한 가지를 발견하게 되죠.
원자들에 알파입자를 충돌시킬 때마다 종류에 상관없이 그 주변엔 항상 수소기체가 생성되었던 것입니다.
참고로 수소 원자는 모든 원자 중 가장 가벼운 원자입니다.
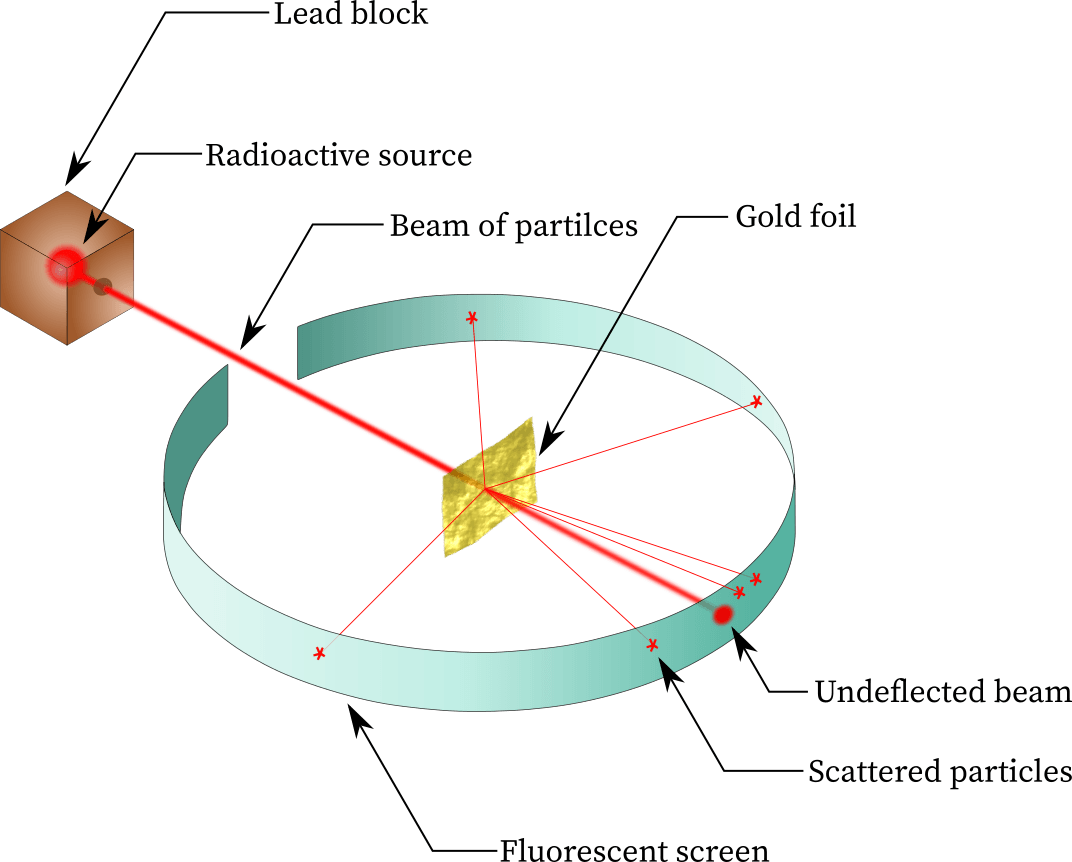
러더퍼드의 금박 충돌실험
러더퍼드는 이 결과를 통해 알파입자와 충돌로 인하여 붕괴한 원자들이 수소 원자를 방출한 것이며, 수소 원자가 모든 종류의 원자핵을 구성하는 기본 구성요소라고 보았습니다. 바로 양성자의 발견이었죠.
그리고 러더퍼드는 이 양성자가 전자와 반대이지만 같은 양의 전하를 지니고 있다는 것도 발견하게 됩니다.
이것은 원자가 양성자와 같은 수의 전자를 지니고 있다는 것을 뜻하는 것이었죠.
이 특징을 입자가 전기적으로 중성을 띄고 있다고 하는데, 만약 모든 입자가 중성의 전기적 특성을 띠고 있지 않다면, 우린 아마도 이런 세상에서 살고 있을지도 모릅니다.
그럼 이 양성자와 전자가 물질을 구성하는 최소 단위의 입자인 것 일까요?
안타깝게도 여기엔 문제가 있었습니다. 분명 러더퍼드의 발견에 의하면 특정 원자의 총 질량은 양성자의 수와 전자의 수만큼 합한 값과 일치해야 할 것입니다.
하지만 실험적 사실은 달랐죠. 수소 이외에 다른 원자들은 양성자와 전자를 합한 질량보다 더 무겁게 측정되었던 것입니다. 이것은 분명 양성자와 전자 이외에 또 다른 무언가가 원자 속에 있다는 것을 뜻하는 것이었죠.
중성자의 발견
1920년 영국의 물리학자 러더퍼드는 방사성 물질인 토륨을 이용한 실험에서 특이한 점 한 가지를 발견하게 됩니다.
토륨과 우라늄 같은 방사성 물질들은 우리가 흔히 알고 있는 방사능, 즉, 방사선을 방출하면서 다른 물질로 변해가게 되는데 이전까지는 이 방사선을 x선과 같은 빛, 즉, 눈에는 보이지 않는 고에너지의 전자기파일 것이라고만 생각했었죠.
하지만 러더퍼드는 실험을 통해 방사선이 전자기파인 감마선을 포함한 총 3종류로 분류되며, 이 중 질량과 운동에너지가 큰 입자들로 이루어진 방사선도 있다는 것을 발견하게 됩니다.
러더퍼드는 이 입자를 알파입자라 명명하였으며, 추후 이것이 우리가 흔히 풍선에 넣는 헬륨가스의 이온화 된 원자핵이라는 것도 밝혀내게 되죠. 러더퍼드가 원자핵을 발견하게 도와준 바로 그 알파입자 말입니다.
1932년 프랑스의 부부 물리학자인 졸리오-퀴리 부부는 베릴륨이라는 물질에 알파입자를 쏘는 실험을 진행하던 중
베릴륨이 탄소로 변해가면서 전기적 특성을 띠지 않는 무엇인가를 방출한다는 것을 발견하게 됩니다.
그리고 베릴륨에서 방출된 이 무엇인가가 탄소와 수소의 화합물인 파라핀 왁스에 부딪히면 수소원자핵, 즉, 양성자가 방출된다는 것도 발견하게 되죠.
졸리오-퀴리 부부는 베릴륨에서 방출되어 파라핀의 양성자를 튕겨내는 이 무엇인가를 고에너지의 전자기파일 것이라 보았습니다. 하지만 영국의 물리학자 제임스 채드윅은 이것을 다르게 보았습니다. 전자기파라고 하기에는 양성자를 튕겨낼 정도의 운동에너지를 지닌다는 것이 설명될 수 없었기 때문이죠.
러더퍼드는 흥미로운 사실 한 가지를 더 발견했는데요. 특정 원자의 질량이 해당 원자번호 만큼의 양성자와 전자의 질량을 더한 값보다 크다는 사실을 말입니다. 참고로 여기서 원자번호는 해당 원자의 양성자 개수를 의미합니다.
러더퍼드는 계산을 통해 이 양쪽의 무게 차이가 대략 원자핵 속의 양성자 질량만큼이 된다는 것을 알아냈죠.
그리곤 이 계산 결과를 통해 원자핵 안에 양성자 이외에 전기적 특성을 가지지 않는 어떠한 입자가 있을 것을 예측하곤
이 입자를 중성자라 명명하였습니다.
채드윅은 졸리오-퀴리 부부가 발견했던 의문의 방사선이 그의 스승 러더퍼드가 예측한 중성자일 것이라 예감했습니다.
그리곤 자신의 예감이 사실임을 실험들을 통해 증명해내게 되죠.
중성자 확인 실험
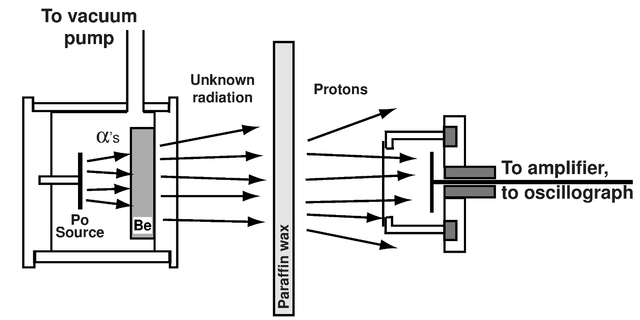
첫째로 파라핀의 양성자가 미지의 입자와 충돌하여 튕겨 나올 때 두 입자 간의 에너지 교환을 계산하였습니다.
참고로 충돌로 인한 양성자의 방출은 에너지보존법칙에 의한 질량이 비슷한 두 입자 간의 탄성 충돌 로 설명할 수 있습니다.
우리는 이것을 질량이 다른 세 공을 이용한 실험을 통해서 쉽게 경험해볼 수 있죠. 그리고 묘기당구가 그 대표적인 예가 될 것입니다.
둘째로 채드윅은 원소 간의 질량 보존법칙에 따른 질량 교환을 계산하여 중성자의 질량을 알아내게 됩니다.
다시 앞의 알파입자를 베릴륨에 충돌시키는 실험으로 돌아가 봅시다. 여기서 실험 전의 베릴륨 원자의 질량과 알파입자의 질량 그리고 충돌로 인해 변환된 탄소 원자의 질량을 안다면 우리는 튕겨 나온 중성자의 질량을 쉽게 계산해낼 수 있게 됩니다.
채드윅은 이러한 방법을 여러 물질에 적용해보며 중성자의 질량을 정확히 계산해내게 되죠.
그리고 그 값은 러더퍼드가 예측한 중성자의 질량과 일치했습니다. 이로써 미지의 존재였던 양성자와 전자 이외에
원자를 이루는 나머지 입자인 중성자가 실험적으로 밝혀 진 것입니다.
그렇다면 앞의 실험들은 이렇게 쉽게 설명 가능해집니다.
물질을 구성하는 모든 종류의 원자들은 양성자의 수에 따라 그 원자의 종류가 나뉘며, 원자의 질량이 클수록 더 많은 수의 양성자와 중성자를 지닙니다.
그런데 이 개수가 특정 개수 이상을 넘어가게 되면 원자핵이 지닐 수 있는 질량 한계치를 넘어 불안정한 원자핵이 됩니다. 마치 우리가 콘위에 아이스크림을 담을 수 있는 한계치가 있는 것처럼 말이죠.
여기에 대해서는 다음에 더 자세하게 다루도록 하겠지만, 이렇게 불안정한 원자핵은 안정적인 원자핵이 되기까지 계속해서 양성자와 중성자를 각각 2개씩 원자핵 밖으로 방출하여 다른 원자로 변하게 됩니다.
이것을 우리는 알파 붕괴에 의한 핵분열이라 하며, 방출된 양성자 2개와 중성자 2개로 구성된 입자가 바로 우리가 알파입자라 부르는 헬륨의 원자핵이 됩니다.
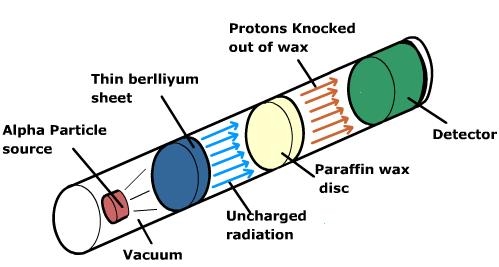
이제 방사성 물질에서 방출된 이 알파입자는 베릴륨에 도달하게 됩니다.
참고로 베릴륨은 양성자 4개와 중성자 5개로 이루어진 원자입니다.
이 베릴륨에 도달한 알파입자는 베릴륨의 원자와 결합하여 양성자 6개와 중성자 6개로 이루어진 안정적인 탄소원자로 변하게 됩니다. 그리곤 여분의 중성자 한 개를 방출하게 되죠.
오늘의 주인공인 바로 그 중성자 말입니다. 이렇게 방출된 중성자는 탄소와 수소의 화합물로써 많은 수의 수소 원자핵을 지닌 파라핀에 도달하게 됩니다. 그리곤 앞선 당구공의 예시처럼 중성자와 질량이 거의 같은 파라핀의 수소원자핵, 즉, 양성자를 탄성 충돌로 인해 밀어내게 되죠.
이렇듯 중성자의 발견으로 이후 물리학과 화학의 많은 부분이 설명 가능해지게 되면서 채드윅은 1935년 노벨물리학상을 받게 됩니다.
그리고 이 발견은 이후 인류 역사에 많은 영향을 미치게 되죠.
그렇다면 지금까지 발견된 전자, 양성자, 중성자가 물질을 이루는 최소단위의 입자일까요?