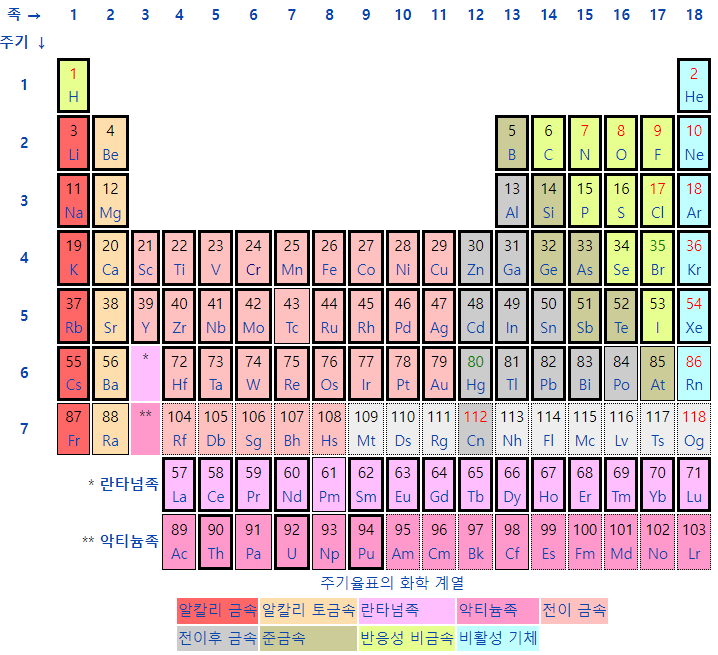
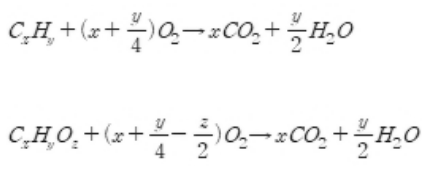리튬, Lithium, 하얀 석유분류알칼리 금속상태고체원자량6.941밀도0.534 g/cm3녹는점180.50 °C끓는점1330 °C용융열3.00 kJ/mol증발열136 kJ/mol원자가1이온화에너지520.2, 7298.1, 11815 kJ/mol전기음성도0.98전자친화도59.6 kJ/mol발견J. A. Arfwedson (1817)CAS 등록번호7439-93-2이전 원소헬륨(He)다음 원소베릴륨(Be) 가장 밀도가 낮은 금속 원소로, 원자번호 3번. 때문에 가장 가벼운 금속성이며 상온에서 고체인 원소이다. 주기율표 제1족에 속하는 알칼리 금속의 하나로서 ,원자량 6.941, 녹는점 180.54℃, 끓는점 1347℃, 비중 0.534을 갖는다. 알칼리 금속이기에 덩어리를 물에 넣으면 폭발적으로 반응한다...