ALDH2, 알데하이드 탈수소효소, Aldehyde Dehydrogenase2, 아세트알데하이드 해독

ALDH
알데하이드 탈수소효소(영어: aldehyde dehydrogenase, ALDH) (EC 1.2.1.3)는 알데하이드의 산화를 촉매하는 효소군(群)이다. 알데하이드 탈수소효소는 알데하이드(R–C(=O)–H)를 카복실산(R–C(=O)–O–H)으로 전환시키는 반응을 촉매한다. 산소는 물 분자에서 나온다. 현재까지 19가지의 알데하이드 탈수소효소 유전자가 사람의 유전체 내에서 확인되었다. 이들 알데하이드 탈수소효소는 외인성 및 내인성 알데하이드의 해독을 포함한 다양한 생물학적 과정에 참여한다.
ALDH2
알데하이드 탈수소효소(Aldehyde Dehydrogenase2, ALDH2
ALDH2는 아세트알데하이드를 해독해 산화 스트레스를 완화하는 효소
알코올의 代謝에는 에탄올을 아세트알데히드로 바꾸는 ‘알코올 脫水素酵素(ADH:탈수소효소)’와 다음 단계에서 이 아세트알데히드를 식초산으로 바꿔주는 ‘아세트알데히드 脫水素酵素(ALDH)’가 중요한 역할을 한다. 아세트알데히드는 강력한 약리작용을 가져 인체에 유해하지만 ALDH에 의하여 재빨리 無害(무해)한 식초산으로 바뀌는 것이다.
소량의 술을 마시고도 나쁜 증상이 나타나는 사람은 이 ALDH 효소에 뭔가 變異(변이)가 발생하여 그 때문에 대사능력이 약해지고 아세트알데히드를 쉽게 식초산으로 대사할 수 없게 된다. 그렇게 되면 몸 안에서 아세트알데히드 농도가 증가하고 몸에 이상이 생긴다.
肝(간) 속에는 다량의 ALDH가 있다. 일본 학자들이 무작위로 일본인의 간으로부터 추출액을 얻어 전기분리법으로 분석해보았다. 분리속도가 빠른 것을 ALDH2, 늦은 것을 ALDH1이라 이름 붙였다.

⊙ 알코올 흡수 : 마신 알코올은 위에서 20~25%가 흡수되는데, 음주 속도, 음식 존재 여부, 위배출시간(공복) 등에 의해 결정된다. 이후 십이지장 및 소장에서 나머지가 흡수되는데, 흡수 속도가 매우 빠르다.
⊙ 알코올 제거 : 마신 알코올은 90~98%가 대사되어 제거되며, 극히 일부는 호흡(0.7%), 소변(0.3%), 땀(0.1%)으로 배출된다. 마신 알코올은 위에서 알코올대사효소에 의해서 6~30%가 분해되며(1st pass metabolism), 나머지는 간에서 분해된다(2nd pass metabolism).
따라서 1st pass metabolism이 저하된 경우, 즉 위배출속도 증가(공복 시나 급한 음주), 위점막 손상(위염, 위절제술), 여성, 동양인 등에서는 알코올에 의한 신체손상 가능성이 더 커진다. 2nd pass metabolism 저하는 알코올분해효소의 유전자다형성이나 기존의 간손상 정도가 관련된다.
⊙ 알코올 대사
알코올 대사에는 oxidative & non-oxidative pathway가 있으나, 후자의 역할을 미미하며 주로 아래와 같은 oxidative pathway에 의한다.
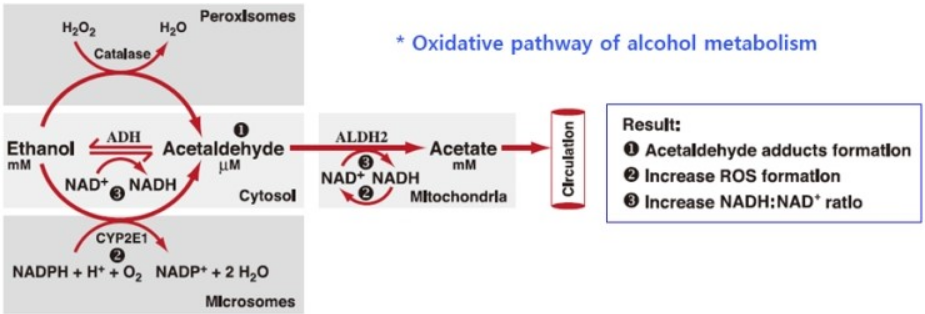
* Alcohol Research & Health 2006;29:247.
⊙ 알코올분해효소
① ADH (alcohol dehydrogenase)와 ALDH (acetaldehyde dehydrogenase)는 위, 간에 존재하면서 전체 알코올대사의 80% 정도를 담당한다.
② MEOS (microsomal ethanol oxidizing system, CP45)는 간에 존재하면서 알코올대사의 20%를 담당한다. CYP2E1은 만성 음주에 의해 유도되는 alternative pathway이며, ROS (reactive oxygen species) 생성으로 더 많은 조직(뇌, 심장, 폐, 중성구, 대식세포 등)의 손상을 유발한다.
③ Catalase는 간에 존재하면서 알코올대사의 2%를 담당하는 minor pathway로 H2O2를 생성한다.
| * 동양인이 술에 더 약한 이유 알코올의 중간대사산물인 아세트알데히드의 대사에 관여하는 ALDH2는 유전자다형성으로 ALDH2*1과 ALDH2*2가 있으며, ALDH2*2의 경우 활성이 없다(inactive). 따라서 ALDH2*2를 보유한 사람은 음주 후 혈중 아세트알데히드가 증가하면서 부정적인 신체반응이 일어나며, 이 결과로 음주에 대한 거부반응이 생긴다. ALDH2*2 동형접합체(homozygotes)인 경우 아세트알데히드를 전혀 분해하지 못함으로써 음주에 의한 신체반응이 극대화되고, 심하면 쇼크에 빠질 수도 있다. 그런데 극동지역인 대만, 중국 한족, 일본인의 50% 정도에서 ALDH2*2를 보유하는 것으로 밝혀졌고, 우리나라 사람도 크게 다르지 않을 것으로 추정한다. |
⊙ 알코올대사산물, 아세트알데히드(acetaldehyde)와 아세테이트(acetate)
아세트알데히드는 반응성이 높은 독성물질로 세포의 구조단백과 결합하여 조직손상을 유발한다. 간세포내 tubulin과 결합하여 단백분비장애로 간종대가 발생하며, 적혈구세포막단백과 결합하여 macrocytosis를 일으킨다. 뇌에서는 도파민과 결합하여 알코올의존 발생에 기여하며, carcinogenic DNA adduct를 형성하여 암발생 위험을 증가시킨다.
알코올의 최종산물인 아세테이트는 혈액으로 배출되어 뇌, 심장, 골격근에서 CO2로 산화된다. 과거에는 무해하다고 알려졌었으나 최근 연구에 의하면 간으로의 유입혈류를 증가시키며, 중추신경계를 억압하고, acetyl CoA로 대사되어 콜레스테롤 합성에 관여한다고 한다.
⊙ 만성 음주의 신체 영향
| 뇌 | Wernicke's encephalopathy Korsakoff's psychosis 알코올 치매, 뇌경막하 출혈 |
췌장 | 급성 및 만성 췌장염 |
| 눈 | Wernicke's ophthalomoplegia | 위십이지장 | 출혈성 위염, 위십이지장 궤양 |
| 인두 | 암 증가 | 생식기 | 성기능 장애, 불임 임산부 : 태아알코올증후군, 선천성 결손증(기형) |
| 심장 | 확장성 심근증 | 관절 | 대퇴골두 무혈성 괴사, 골다공증, 통풍 |
| 폐 | 폐렴이나 폐결핵 감염 감수성 증가 | 근육신경계 | 말초신경염, 근증, 균형조절 장애 |
| 간 | 지방간, 간염, 간경변 | 대사 | 당조절 악화, 저혈당, 영양 실조 |
▶ 간질환의 분류
알코올 간질환은 크게 알코올 지방간, 알코올 간염, 알코올 간경변으로 대별하며, 간세포암도 발생할 수 있다. 이러한 질환들은 단독으로 있는 경우도 있지만, 여러 단계가 동시에 존재할 수 있다.
⊙ 알코올지방간(alcoholic fatty liver) : 과음자의 80~90%에서 발생하며, 단주하면 회복된다.
⊙ 알코올간염(alcoholic hepatitis) : 임상 양상이 다양하여, 경미한 경우 알코올지방간과 구분이 어려우며 중증 알코올간염은 황달이 심하게 발생하고 P-time이 연장되는 등 급성 간부전과 유사한 경과를 밟아 예후가 매우 불량하다.
알코올간염은 간섬유화 진행이 흔하며, 지속적으로 음주하면 38~56%에서 간경변증으로 진행한다. 진단 당시 간경변 동반율은 50% 정도이며, 간경변 없이도 복수, 정맥류출혈 등의 문맥압항진증이 발생할 수 있어 감별이 필요하다.
⊙ 알코올간경변(alcoholic cirrhosis) : 알코올 간경변 진단 시점에 3/4 정도에서서 합병증이 동반되는데, 복수가 제일 많고(55%), 이어서 정맥류출혈(6%), 복수와 정맥류출혈 모두 동반(4%), 간성뇌증(1%) 순이다. 간경변증 진단 후 1년 내 비대상성으로 진행하는 경우가 38%로 비알코올성 간경변의 25%에 비해 진행률이 높다.
| * 알코올 간염에서 간경변이 없는 데도 불구하고 문맥압항진증이 발생하는 이유 알코올간염은 hepatic outflow의 시발점이라고 할 수 있는 중심정맥(central vein) 주변부터 병변이 발생한다. 이것은 알코올분해가 산소를 필요로 하는 대사과정이기 때문에 산소가 상대적으로 적은 zone 3 (중심정맥 주변)가 알코올 손상에 취약하기 때문이다. Zone 3에 간세포 손상이 시작되어 콜라겐이 침착되면 병리학적으로 central hyaline sclerosis 소견이 관찰된다. 이렇게 모든 중심정맥부위가 손상을 받으면 hepatic outflow가 막히면서 간문맥 압력이 높아지고 정맥류출혈이나 복수 등 간문맥압항진증 소견이 발생할 수 있다. 즉, 알코올 환자에서 문맥압항진증이 있더라도 간조직검사를 하지 않는 한 알코올간경변으로 진단해서는 안된다. 문맥압항진증 증상이 있는 알코올 환자에서 금주를 잘 지키면서 열심히 치료받는 경우 어느 날엔가 완쾌되는 경우도 있음을 주지해야 한다. |
▶ 알코올간질환의 자연경과
알코올간질환에서 간섬유화의 발생 및 진행은 간경변증으로의 진행에 중요한 역할을 하며, 알코올간질환의 조직학적 손상에 따라서 다양하게 나타난다.
아직 알코올간질환의 자연경과는 명확하지 않으나, 음주 지속 여부가 자연경과를 결정하는 데 매우 중요하다. 어떠한 유형의 알코올간질환이든 단주는 질환의 진행을 막고 생존율도 향상시키며 간이식도 줄일 수 있으나, 5~15%는 단주를 하여도 간섬유화나 간경변증으로 진행할 수 있다.
알코올간질환 환자의 사망률은 평균 480일 추적검사한 연구에서 14.6% 정도였고, 주 사망원인은 정맥류출혈(31.1%), 간부전(24.5%), 간신증후군과 패혈증(11.3%) 순이라는 국내 다기관 연구가 있다.
▶ 알코올간질환의 위험인자
1. 음주량 : 술의 종류에는 관계 없이 용량의존적으로 손상을 받는다. 일반적으로 위험량은 남자가 1주에 21표준잔, 여자가 14표준잔 이상 정도 된다(1표준잔은 순수 알코올 12 g 정도).
2. 음주 습관 : 간헐적 음주보다 매일 음주하는 것이 더 위험하다.
3. 성별 : 남성보다 여성이 음주에 더 취약한데, 위내의 알코올 분해효소가 적고, 알코올의 생체이용도가 증가하며, 에스트로겐에 의한 산화스트레스가 더 심하기 때문이다.
4. 유전인자 : 일란성 및 이란성 쌍둥이 알코올간질환의 차이가 있는 것으로 나타났다. 알코올대사효소의 유전자다형성도 관련이 있다.
5. 기타 : 바이러스간염 동반 여부, 흡연, 영양결핍, 비만, 인종(백인보다 흑인과 라틴아메리카 남성이 더 취약)
| * 알코올대사효소의 유전자다형성과 간손상 ALDH2*2 유전자에서 만들어진 분해효소는 활성도가 현저히 낮다. 따라서 음주 후 아세트알데히드 분해가 지연되면서 축적된 아세트알데히드가 신체에 부정적인 반응을 일으키고, 이것이 음주에 대한 거부반응으로 이어져 알코올 중독에 빠질 위험성을 적게 한다. 동양인 대상의 메타분석에서 ALDH2*2 대립유전자가 있는 경우 알코올 의존과 알코올 간질환의 빈도가 낮았다. 우리나라에서 ALDH2*2의 대립유전자 빈도는 알코올 간경변증 환자에서 의미 있게 낮았는데, 추정컨대 이 대립유전자를 보유한 사람은 술을 덜 마실 가능성이 있다. |
Aldehyde dehydrogenase, mitochondrial is an enzyme that in humans is encoded by the ALDH2 gene located on chromosome 12. ALDH2 belongs to the aldehyde dehydrogenase family of enzymes. Aldehyde dehydrogenase is the second enzyme of the major oxidative pathway of alcohol metabolism. ALDH2 has a low Km for acetaldehyde, and is localized in mitochondrial matrix. The other liver isozyme, ALDH1, localizes to the cytosol.
Most White people have both major isozymes, while approximately 50% of East Asians have the cytosolic isozyme but not a functional mitochondrial isozyme. A remarkably higher frequency of acute alcohol intoxication among East Asians than among Whites could be related to this absence of a catalytically active form of ALDH2. The increased exposure to acetaldehyde in individuals with the catalytically inactive form may also confer greater susceptibility to many types of cancer.
Gene
The ALDH2 gene is about 44 kbp in length and contains at least 13 exons which encode 517 amino acid residues. Except for the signal NH2-terminal peptide, which is absent in the mature enzyme, the amino acid sequence deduced from the exons coincided with the reported primary structure of human liver ALDH2. Several introns contain Alu repetitive sequences. A TATA-like sequence (TTATAAAA) and a CAAT-like sequence (GTCATCAT) are located 473 and 515 bp, respectively, upstream from the translation initiation codon.
Enzyme structure
ALDH2 is a tetrameric enzyme that contains three domains; two dinucleotide-binding domains and a three-stranded beta-sheet domain. The active site of ALDH2 is divided into two halves by the nicotinamide ring of nicotinamide adenine dinucleotide (NAD+). Adjacent to the A-side (Pro-R) of the nicotinamide ring is a cluster of three cysteines (Cys301, Cys302 and Cys303) and adjacent to the B-side (Pro-S) are Thr244, Glu268, Glu476 and an ordered water molecule bound to Thr244 and Glu476. Although there is a recognizable Rossmann fold, the coenzyme-binding region of ALDH2 binds NAD+ in a manner not seen in other NAD+-binding enzymes. The positions of the residues near the nicotinamide ring of NAD+ suggest a chemical mechanism whereby Glu268 functions as a general base through a bound water molecule. The sidechain amide nitrogen of Asn169 and the peptide nitrogen of Cys302 are in position to stabilize the oxyanion present in the tetrahedral transition state prior to hydride transfer. The functional importance of residue Glu487 now appears to be due to indirect interactions of this residue with the substrate-binding site via Arg264 and Arg475.
